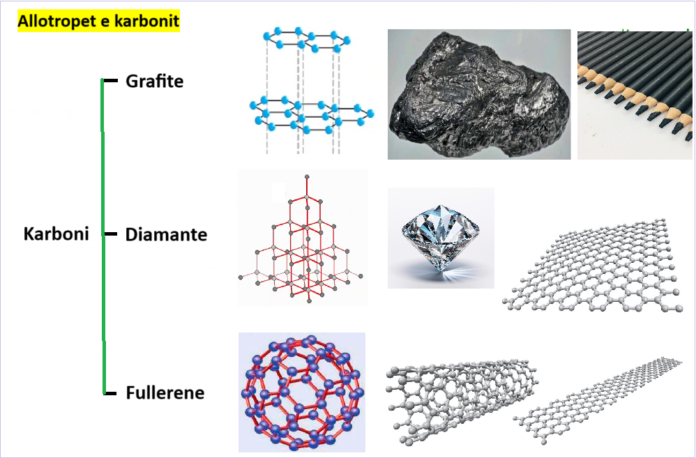
Karboni ka tre allotrope kryesore: grafit, diamant dhe fullerene. Allotropet e karbonit përbëhen vetëm nga atomet e karbonit. Kështu, të gjitha ato janë forma më e pastër e karbonit. Çdo atom karboni mund të formojë një maksimum prej katër lidhjesh. Si rezultat, mund të marrë disa forma.
Allotropia është ekzistenca e dy ose më shumë formave të ndryshme fizike të një elementi kimik.
Allotropet janë dy ose më shumë forma të të njëjtit element kimik që ndryshojnë nga njëri-tjetri në mënyrën se si atomet lidhen me njëri-tjetrin. Për shkak të lidhjeve të tyre të ndryshme kimike, allotropet kanë veti të ndryshme fizike dhe kimike. Allotropia i referohet substancave elementare, ndërsa polimorfizmi i ngjashëm i referohet vetëm komponimeve.
Karboni, për shkak të aftësisë së tij për të pasur gjendje oksidimi të ndryshueshme ose numra koordinimi, e bën karbonin një nga elementët e paktë që ka numër të shumëfishtë formash allotropike.
Alotropet e karbonit kanë forma të ndryshme fizike në të cilat atomet e tyre mund të rregullohen dhe të lidhen. Secili korrespondon me një material të ngurtë me karakteristikat e tij të veçanta. Në mënyrë molekulare dhe strukturore ato dallohen nga njëra-tjetra. Ekzistojnë dy lloje kryesore të këtyre alotropave: kristalor dhe amorf.
Lidhjet kovalente të karbonit
Para se të adresoni disa nga alotropet e njohura të karbonit, është e nevojshme të rishikoni se si lidhen atomet e karbonit.
Sipas teorisë së lidhjes së valencës, karboni ka katër elektrone në predhën e tij të valencës, me të cilët ato formojnë lidhje kovalente. Falë promovimit elektronik dhe hibridizimit, të katër elektronet mund të vendosen në katër orbitale të ndara, qofshin ato të pastra apo hibride.
Prandaj, karboni ka aftësinë të formojë deri në një maksimum prej katër lidhjeve.
Ndërsa ekzistojnë katër lidhje C-C, atomet arrijnë oktetin e valencës, dhe ato bëhen shumë të qëndrueshme. Sidoqoftë, kjo nuk do të thotë që nuk mund të ketë vetëm tre nga këto lidhje, të tilla si ato që shihen në gjashtëkëndësh.
Gjashtëkëndësh
Në varësi të hibridizimeve të atomit të karbonit, lidhje të dyfishta ose të trefishta mund të gjenden në strukturën e allotropave të tyre përkatëse. Por, edhe më e qartë se ekzistenca e lidhjeve të tilla, është gjeometria që karbonët marrin.
Për shembull, nëse vërehet një gjashtëkëndësh, kjo do të thotë që karbonët kanë hibridizim sp2 dhe për këtë arsye kanë një orbitale f i paster me nje elektron te vetmuar. A mund të shihni gjashtëkëndësh të përsosur në imazhin e parë? Ato alotropë që i përmbajnë ato nënkuptojnë që karbonët e tyre janë sp2 pavarësisht nëse ka lidhje të dyfishta (si ato të unazës së benzenit).
Një shtresë rrjetë, rrafshi ose gjashtëkëndore përbëhet nga karbonët sp2 që ka një “tavan” ose “re” elektronike, produkt i elektronit të pa çiftuar të orbitës f. Ky elektron mund të formojë lidhje kovalente me molekula të tjera, ose të tërheqë ngarkesat pozitive të joneve metalike; si K+ dhe Na+.
Po kështu, këta elektronë lejojnë që këto predha të vendosen njëra mbi tjetrën, pa u lidhur (për shkak të një pengese gjeometrike dhe hapësinore në mbivendosjen e dy orbitaleve f) Kjo do të thotë që allotropet me gjeometri gjashtëkëndore mund të porositen ose jo për të ndërtuar një kristal.
Tetrahedra
Nëse vërehet një katërkëndësh, siç do të shpjegohet në seksionin e fundit, kjo do të thotë që karbonët kanë hibridizim sp3. Në to ka katër lidhje të vetme C-C, dhe ato formojnë një rrjet kristal tetraedral. Në tetraedra të tilla nuk ka elektron të lirë siç ka në gjashtëkëndësh.
–
Fenomeni me të cilin një element mund të ekzistojë në më shumë se një gjendje fizike quhet allotropi. Allotropet e karbonit mund të kategorizohen në dy:
- Allotropet amorfe të karbonit
- Allotropet kristalore të karbonit
–
Allotropet e karbonit amorf
Karboni në forma allotropike amorfe përfshin: Qymyr (thëngjill), qymyr druri të bërë nga druri i pemëve, qymyr druri nga kafshët, qymyr druri i bërë nga sheqeri, llamba dhe karboni i gazit.
Karboni amorf mund të imagjinohet si një lloj sfungjeri poroz, me shumë rrjete gjashtëkëndëshe dhe tetraedrale të rregulluara në mënyrë arbitrare.
Kështu, varësisht nga% e karbonit, rrjedhin lloje të ndryshme të karbonit amorf; të tilla si bloza, qymyri, antraciti, karboni i zi, torfe, koksi dhe karboni aktiv.
Në shikim të parë, të gjithë ata duken nga distanca të ngjashëm (imazhi i sipërm), me gradime në buzë të ngjyrave të zeza, të mbytura, ose metalike dhe gri.
Jo të gjithë karbonët amorfë kanë të njëjtën origjinë. Karboni i perimeve, siç sugjeron emri i tij, është produkt i djegies së masave të perimeve dhe drurit. Ndërsa karboni dhe koksi janë produkte të fazave dhe kushteve të ndryshme të proceseve të naftës. Megjithëse ato nuk duken shumë tërheqëse dhe mund të besohet se ato shërbejnë vetëm si lëndë djegëse, porozitetet e lëndëve të tyre të ngurta tërheqin vëmendjen në aplikimet e pastrimit teknologjik, të tilla si thithjet dhe depozitimet e substancave, dhe gjithashtu si mbështetëse katalitike.
Politypism
Strukturat e karbonit amorf janë komplekse dhe të çrregulluara; Sidoqoftë, studimet kristalografike kanë treguar se ato janë në të vërtetë politepe tetraedrale (diamantë) dhe gjashtëkëndëshe (grafiti), të renditura në mënyrë arbitrare në shtresa.
Për shembull, nëse T dhe H janë përkatësisht shtresat tetraedrale (T) dhe gjashtëkëndëshe, (H – Heksagon), atëherë një karbon amorf mund të përshkruhet në mënyrë strukturore si: THTHHTH; ose HTHTTHHHT, etj. Sekuenca të caktuara të shtresave T dhe H përcaktojnë një lloj karboni amorf; por brenda tyre, nuk ka asnjë trend apo model të përsëritur.
Grupet funksionale
Është përmendur që rrafshet gjashtëkëndësh kanë një elektron të pa çiftuar me të cilin mund të formojë një lidhje me molekulat ose atomet e tjera. Nëse, për të thënë, molekulat përreth janë H2O dhe CO2, Grupet e OH dhe COOH pritet të formohen, përkatësisht. Ata gjithashtu mund të lidhen me atomet e hidrogjenit, duke formuar lidhje C-H. Mundësitë janë shumë të ndryshme, por në përmbledhje karbonët amorfë mund të presin grupe funksionale të oksigjenuara. Kur këto heteroatome janë të pranishme, ato jo vetëm që ndodhen në skajet e rrafsheve, por edhe madje edhe brenda tyre.
–
Allotropet kristalore të karbonit
Ka allotrope të ndryshme kristalore të karbonit, disa prej të cilave janë si më poshtë:
- Grafiti
- Diamant
- Fullerene
- Nanotubat e karbonit
–
Grafiti
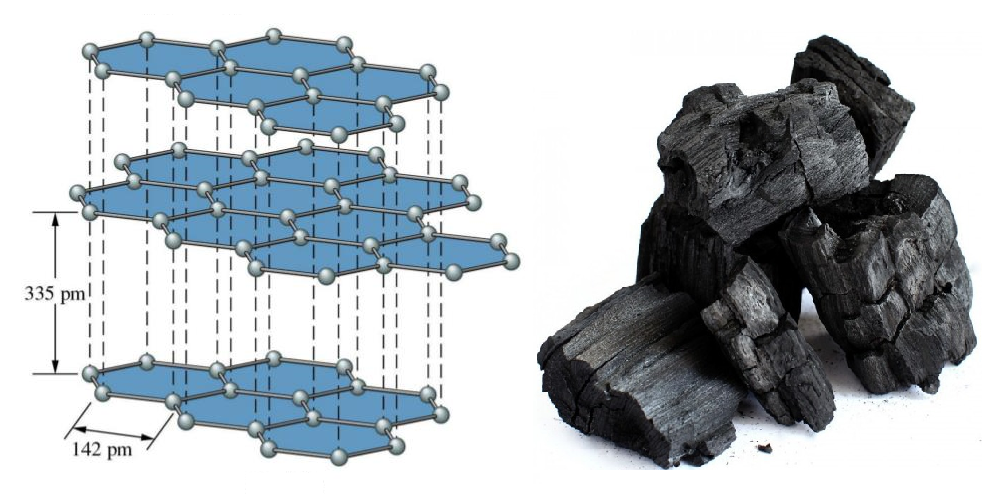
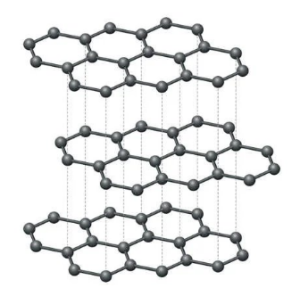
Grafiti përmban shtresa të atomeve të karbonit. Është një formë e pastër karboni. Ky allotrop i karbonit është i përbërë nga shtresa të sheshta dydimensionale të atomeve të karbonit, të cilat janë të rregulluara në mënyrë heksagonale. Është një solide e butë, e zezë dhe rrëshqitëse. Kjo veti e grafitit vazhdon sepse shtrëngohet lehtë midis shtresave.
Në çdo shtresë, çdo atom C është i lidhur me tre atome C nëpërmjet një lidhjeje kovalente C-C. Çdo karbon këtu është sp2 i hibridizuar. Lidhja e katërt formohet si një lidhje pi. Meqë π-elektronet janë të delokalizuara, ato janë të lëvizshme dhe mund të kryejnë elektricitet.
Grafiti është i dy formave: α dhe ß.
Në formën α, shtresat janë të rregulluara në sekuencën e ABAB, me shtresën e tretë saktësisht mbi shtresën e parë.
Në formën ß, shtresat janë të rregulluara si ABCABC.
Vetitë e grafitit
- Meqë shtresat janë grumbulluar mbi njëra-tjetrën, ky allotrop karboni mund të veprojë si lubrifikant.
- Ajo ka gjithashtu një lustër metalike, e cila ndihmon në përçimin e elektricitetit. Është një përçues shumë i mirë si i nxehtësisë, ashtu edhe i elektricitetit.
- Një nga vetitë më të rëndësishme të grafitit është se përdoret si lubrifikant i thatë për makinat në temperatura të larta ku nuk mund të përdorim vaj.
- Grafiti përdoret për të bërë thërrime të cilat kanë vetinë se janë inerte për të holluar acidet si dhe për alkalis.
- Grafiti është i zi, i shndritshëm dhe Opaque. Nuk është transparente. Është gjithashtu një material shumë i rrëshqitshëm. Përdoret në laps çon sepse shtresat rrëshqasin lehtësisht në letër, duke lënë një shenjë të zezë. Është një përbërës i shumë lubrifikantëve, për shembull vaji i zinxhirit të biçikletave.
- Grafiti është i patretshëm ose i pazgjidhshëm në ujë. Ka një pikë të lartë shkrirjeje dhe është një përçues i mirë i energjisë elektrike, gjë që e bën atë një material të përshtatshëm për Elektrodat E nevojshme në Elektrolizë.
Shënim: Në krahasim me diamantin, grafiti është termodinamikisht më i qëndrueshëm.
Struktura e allotropit të karbonit (grafit)
Grafiti ka një strukturë unike të shtresëzuar të huallit të mjaltit. Çdo shtresë është e përbërë nga unaza hexagonale planare të atomeve të karbonit në të cilat gjatësia e lidhjes karboni-karboni brenda shtresës është 141.5 picometera. Nga katër atome karboni, tre formojnë lidhje sigma, ndërsa karboni i katërt formon pi-bono. Shtresat në grafit mbahen së bashku nga forcat Vander Waal.
–
Diamanti
Është allotropi kristalor më i pastër i karbonit. Ajo ka një numër karbonesh të lidhura së bashku në mënyrë tetraedrally. Çdo njësi tetraedrale përbëhet nga karboni i lidhur me katër atome karboni të cilat nga ana e tyre janë të lidhura me karbonat e tjerë. Kjo krijon një allotrope të karbonit që ka një rregullim tredimensional të C-atomeve.
Çdo karbon është sp3 i hibridizuar dhe formon lidhje kovalente me katër atome të tjera karboni në cepat e strukturës tetraedrale.
imazh: Struktura e diamantit
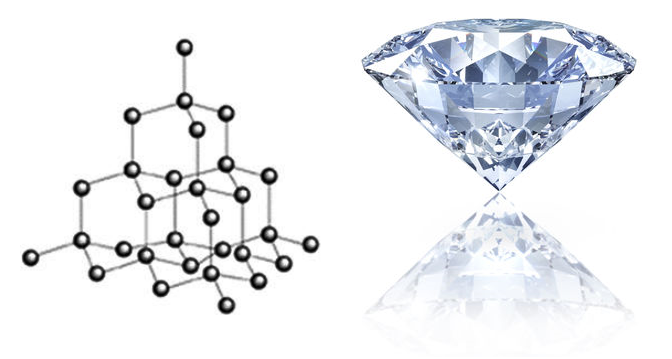
A e dini pse një diamant është i vështirë?
Është e vështirë, sepse thyerja e një kristali diamanti përfshin prishjen e shumë lidhjeve të forta kovalente. Thyerja e lidhjeve kovalente nuk është një detyrë e lehtë. Kjo veti e bën këtë allotrope karboni elementin më të vështirë në tokë.
Vetitë fizike të diamantit
- Është jashtëzakonisht e vështirë
- Ka një pikë shkrirjeje shumë të lartë
- Ka një dendësi relative të lartë
- Është transparente ndaj rrezeve X
- Ka një vlerë të lartë të indeksit refraktar
- Është një përçues i keq i elektricitetit
- Është një përçues i mirë i nxehtësisë
- Është i pazgjidhshëm në të gjithë solvantët
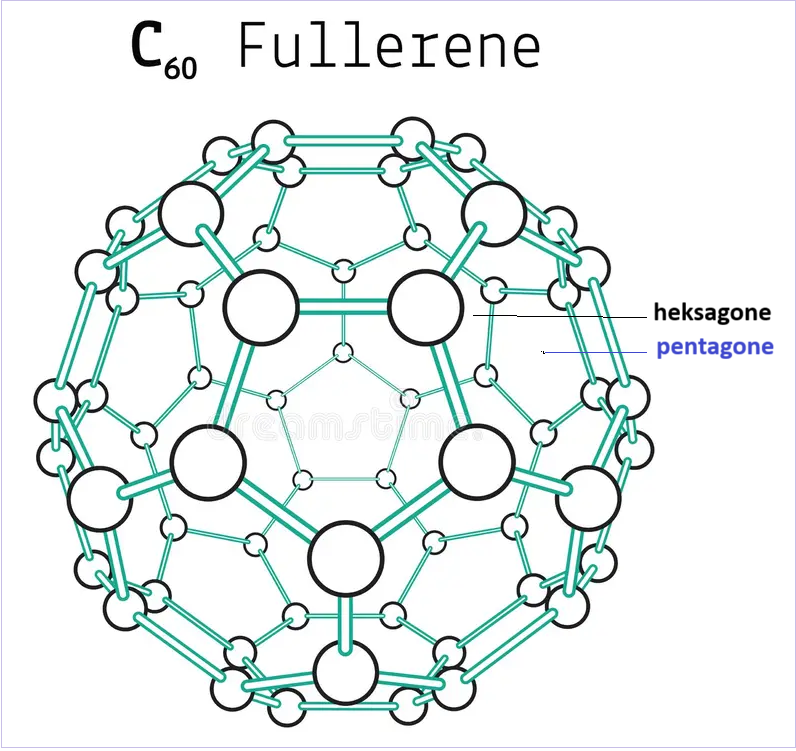
Fullerene
Buckminsterfullerene (C60) është gjithashtu një nga allotropet e karbonit. Struktura e fullerenës është si një formë kafazi, për shkak të së cilës duket si një futboll.
Fullerenet
Ato janë molekula sferoidale që kanë përbërjen C2n, ku n ≥ 30. Këto allotrope karboni mund të përgatiten duke avulluar grafitin me laser.
Ndryshe nga diamantet, fullerenët shpërbëhen në solvantazhe organike. Fullerene C60 quhet ‘Buckminster Fullerene‘. Atomet e karbonit janë të hibridizuara sp2.
Shënim: Në C60 ka 12 unaza me pesë anëtarë dhe 20 unaza me gjashtë anëtarë.
Vetitë e Fullerenit
Veti të ndryshme të Fullerene janë :
- Kur ndryshon temperatura, sjellja dhe struktura e fullerenës ndryshojnë. Fullerene transformohet në C70 Formohet në një temperaturë më të madhe.
- Nën presionet e ndryshueshme, struktura e fullerenës ndryshon.
- Ka një entalpy jonizimi prej 7.61 volt elektronesh.
- Ka një përkatësi elektronesh prej 2.6 deri në 2.8 volt elektron.
- Në proceset kimike, fullerene (C60) imiton një elektrofil.
- Ka aftësinë të sillet si pranues elektronesh. Ai mund të marrë lehtësisht tre ose më shumë elektrone. Si rezultat, ajo ka potencialin të veprojë si një agjent oksidues.
- Doped me metale alkali ose alkaline të tokës për të arritur superpërkushtueshmërinë.
- Është ferromagntic në natyrë.
- Është shumë i vetmuar në solvantazh organik.
–
Nanotubat e karbonit
Nanotubet janë një lloj fullereni dhe janë tuba molekularë të karbonit të rregulluara në mënyrë të ngjashme me shtresat në grafit.
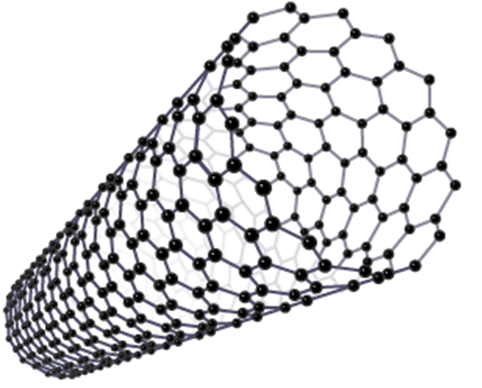
Nanotubat e karbonit kanë një pikë shkrirjeje shumë të lartë, pasi çdo atom karboni bashkohet me tre atome të tjera karboni nga lidhje të forta kovalente. Kjo gjithashtu lë çdo atom karboni me një elektron rezervë, i cili formon një det të elektroneve të delokalizuara brenda tubit, që do të thotë se nanotubet mund të kryejnë elektricitet.
Sa allotrope karboni ka?
- Diamanti: Është një kristal jashtëzakonisht i vështirë dhe transparent me atome karboni të rregulluara në një latice tetraedrale. Ky allotrop i karbonit është një përçues elektrik i dobët dhe një përçues termik i shkëlqyer.
- Lonsdaleite: Quhet edhe diamant heksagonal.
- Grafene: Është elementi bazë strukturor i allotropeve të tjera, nanotubeve, qymyrit dhe fullerenes.
- Q-karboni: Këto allotrope karboni janë ferromagnetike, të forta dhe të shkëlqyera strukturë kristali që është më e vështirë dhe më e ndritshme se diamantet.
- Grafiti: Është një i butë, i zi, i ngurtë i flaktë, një përçues elektrik i moderuar. Atomet C janë të lidhura në latice të sheshta heksagonale (grafenë), të cilat pastaj janë të shtresëzuara në fletë.
- Karboni linear acetilenik (Carbyne)
- Karboni amorf
- Fullerenes, duke përfshirë buckminsterfullerene, i njohur edhe si “buckyballs”, të tilla si C60.
- Nanotubat e karbonit: Allotropet e karbonit me një nanostrukturë cilindrike.
–
- Burimet: