Hidrogjeni, simboli H, është element kimik i gaztë, pa ngjyrë, pa erë, i patretshëm në ujë dhe që i përket grupit të jometaleve në sistemin periodik të elementeve. Shpërndahet lehtësisht nëpër të gjitha materialet. Është i ndezshëm dhe bën përzierje shpërthyese në ajër. Kur ndizet në ajër, digjet me një flakë të nxehtë të ndritshme që jep avull uji. Në temperatura të larta, kombinohet lehtësisht me oksigjen, squfur dhe elementë halogjenë.
Hidrogjeni në kimi paraqitet me simbolin H dhe numri atomik është 1, numri i masës 100794 amu (njësi të masës atomike). (1H1.00794). Hidrogjeni është elementi më i bollshëm në univers, ai përbën vetëm rreth 0.14 për qind të kores së Tokës sipas peshës.

Hidrogjeni u zbulua në 1766 nga Sir Henry Cavendish (GB). Emri iu dha nga Lavoisie. Megjithatë, në 1766 Henry Cavendish u bë i pari që këtë element në formën e gazit, duke identifikuar reaksionet si ajër të ndezshëm dhe duke zbuluar më thellë se kur digjet gazi mund të prodhojë ujë, kjo ishte në 1781. Kjo vlerësohet me zbulimin e hidrogjenit si një tjetër element kimik. Por emri mori nga Antoine Lavoisier në 1783.
Vetitë e Hidrogjen-it – (nga: Hydrogen1 – Wikipedia)
| Hidrogjeni: 1H |
| Pamja: Gaz pa ngjyrë |
| Hidrogjeni plazmatik: Shkëlqim vjollcë në gjendjen e saj plazmatike |
| Pesha standarde atomike> Ar° (H): 1.0080±0.0002 (shkurtuar) |
| Hidrogjeni në tabelën periodike |
| Numri atomik (Z): 1 |
| Grupi: 1: Hidrogjeni dhe metalet alkalike |
| Periudha: 1 |
| Blloku: S |
| Konfigurimi i elektroneve: 1s1 |
| Elektronet për guaskë: 1 |
| Vetitë fizike |
| Faza në Standard Temperatur e Presion (STP): gaz |
| Pika e shkrirjes: (H2) 13.99 K (−259.16 °C, −434.49 °F) |
| Pika e vlimit: (H2) 20.271 K (−252.879 °C, −423.182 °F) |
| Dendësia (në STP): 0.08988 g/L, |
| Dendësia kur i lëngshëm (në MP): 0.07 g/cm3 (i ngurtë: 0.0763 g/cm3) |
| Dendësia kur i lëngshëm (në BP): 0.07099 g/cm3 |
| Pikë e trefishtë: 13.8033 K, 7.041 kPa |
| Pika kritike: 32.938 K, 1.2858 MPa |
| Nxehtësia e shkrirjes: (H2) 0.117 kJ/mol |
| Nxehtësia e avullimit: (H2) 0.904 kJ/mol |
| Kapaciteti molar i nxehtësisë: (H2) 28,836 J/(mol· K) |
| Presioni i avullit> P (Pa): 1, 10, 100, 1 mijë, 10 mijë në 15 K (temperatur), 100 mijë në 20 K (temperatur). |
| Vetitë atomike |
| Gjendjet e oksidimit e zakonshme: −1, +1 |
| Elektronegativiteti Shkalla e Pauling: 2.20 |
| Energjitë e jonizimit: (e para) 1: 1312.0 kJ/mol |
| Rrezja kovalente: 31±5 pikometër |
| Rrezja e Van der Waals: 120 pikometër |
| Linjat spektrale të hidrogjenit |
| Veti të tjera |
| Dukuria natyrore: parësore |
Struktura kristalore gjashtëkëndor (hP4): 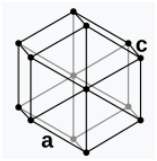 – Grila kristal strukture e Hidrogjenit -a1. Konstantet e grilës: a = 378.97 pm, c = 618.31 pm (në pikën e trefishtë). – Grila kristal strukture e Hidrogjenit -a1. Konstantet e grilës: a = 378.97 pm, c = 618.31 pm (në pikën e trefishtë). |
| Përçueshmëria termike: 0.1805 W/(m⋅K) |
| Renditja magnetike: diamagnetike |
| Ndjeshmëria magnetike molare: −3.98×10−6 cm3/mol (298 K) |
| Shpejtësia e zërit: 1310 m/s (gaz, 27 °C) |
| Numri CAS: 12385-13-6, 1333-74-0 (H2) |
| Histori |
| Emërtimi: emri do të thotë ‘formues uji’ në greqisht |
| Zbulimi dhe izolimi i pare: Henry Cavendish (1766) |
| Emri nga Antoine Lavoisier: (1783) |
| Izotopet e hidrogjenit |
| Izotopet kryesore: 1H: bollëk: 99.9855% i qëndrueshëm, gjysmë jetë (t1/2): i qëndrueshëm. 2H: 0.0145% i qëndrueshëm. 3H: bollëku: gjurmë, gjysmë jetë (t1/2): 12.33 y dhe β− prishja, prodhimi 3He. |
Etimologjia
Hydrogen nga greqishtja hydr- (ujë), -gen (prodhues). E quajtur kështu sepse formon ujë kur ekspozohet ndaj oksigjenit.2
Ky element u lëngëzua për herë të parë nga James Dewar në 1898, i cili përdori ftohje rigjeneruese, shpikja e të cilit është shumë afër asaj që aktualisht quhet termos.
Përdorimet, Hidrogjeni në përgjithësi ka shumë përdorime aktuale dhe potenciale. shih: Përdorimet e Hidrogjeni dhe E ardhmja hidrogjenit.
Izotopet e Hidrogjenit
[Hidrogjeni ka tre izotope natyrale, të shënuara 1H, 2H dhe 3H. Bërthama të tjera, shumë të paqëndrueshme (4H për 7H) janë sintetizuar në laborator, por nuk janë vërejtur në natyrë.]3
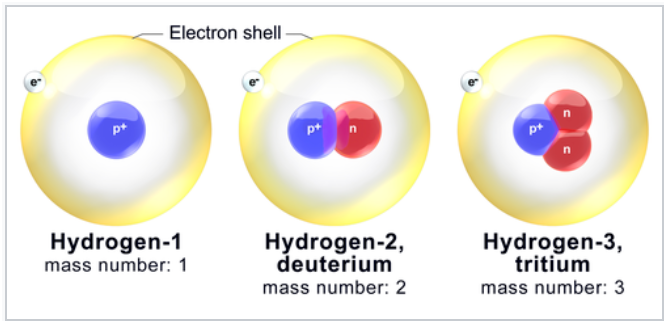
Tre izotopet natyrale të hidrogjenit: hidrogjeni-1 (protium), hidrogjen-2 (deuterium) dhe hidrogjen-3 (tritium). -kredi nga Wikipedia. Blausen 0530 HydrogenIsotopes – Hydrogen – Wikipedia.
[: Hidrogjeni (H), një substancë e gaztë pa ngjyrë, pa erë, pa shije, e ndezshme që është anëtari më i thjeshtë i familjes së elementeve kimike. Atomi i hidrogjenit ka një bërthamë të përbërë nga një proton që mban një njësi ngarkese elektrike pozitive; Një elektron, që mban një njësi ngarkese elektrike negative, është gjithashtu i lidhur me këtë bërthamë. Në kushte të zakonshme, gazi hidrogjen është një grumbullim i lirshëm i molekulave të hidrogjenit, secila e përbërë nga një palë atome, një molekulë dyatomike, H2. Vetia më e hershme e njohur e rëndësishme kimike e hidrogjenit është se ai digjet me oksigjen për të formuar ujë, H2O; në të vërtetë, emri hidrogjen rrjedh nga fjalët greke që nënkuptojnë “krijues uji”.
Megjithëse hidrogjeni është elementi më i bollshëm në univers (tre herë më i bollshëm se heliumi, elementi tjetër më i përhapur), ai përbën vetëm rreth 0.14 për qind të kores së Tokës sipas peshës. Megjithatë, ndodh në sasi të mëdha si pjesë e ujit në oqeane, paketa akulli, lumenj, liqene dhe atmosferë. Si pjesë e komponimeve të panumërta të karbonit, hidrogjeni është i pranishëm në të gjitha indet shtazore dhe bimore dhe në naftë. Edhe pse shpesh thuhet se ka më shumë komponime të njohura të karbonit sesa të çdo elementi tjetër, fakti është se, meqenëse hidrogjeni përmbahet pothuajse në të gjitha komponimet e karbonit dhe gjithashtu formon një mori komponimesh me të gjithë elementët e tjerë (përveç disa prej gazrave fisnikë), është e mundur që komponimet e hidrogjenit të jenë më të shumta.
Hidrogjeni elementar gjen aplikimin e tij kryesor industrial në prodhimin e amoniakut (një përbërës i hidrogjenit dhe azotit, NH3) dhe në hidrogjenizimin e monoksidit të karbonit dhe komponimeve organike.] – Hydrogen | Properties, Uses, & Facts | Britannica4
Bollëku i hidrogjenit
Vlerësohet se 90% e të gjitha atomeve, ose pothuajse 3/4 e masës së universit, janë hidrogjen. Të gjithë yjet, përfshirë Diellin, përbëhen kryesisht nga hidrogjeni (më shumë se 90%). Hidrogjeni gjendet rrallë në natyrë në gjendjen e tij elementare, vetëm në shtresat e sipërme të atmosferës ose në gazrat vullkanikë.
Kryesisht lidhet me komponime, më të bollshmet prej të cilave janë uji (H2O), amoniaku (NH3) dhe komponime të ndryshme organike. Hidrogjeni i pastër merret më shpesh nga elektroliza e ujit. Në laborator merret nga reaksioni i acidit sulfatik dhe zinkut elementar, ndërsa industrialisht merret duke përcjellë avujt e ujit përmes koksit të ndezur.
Përdorimet e Hidrogjenit
Përdoret për sintezën e amoniakut, hidratimin e qymyrit dhe vajit, prodhimin e acidit klorhidrik dhe si agjent reduktues. Çmimi i gazit hidrogjen5 me pastërti 99.999% është 200.70 €/dm3 në paketa të vogla (1 dm3) dhe rreth 2.21 €/dm3 në një paketë të madhe (300 dm3).
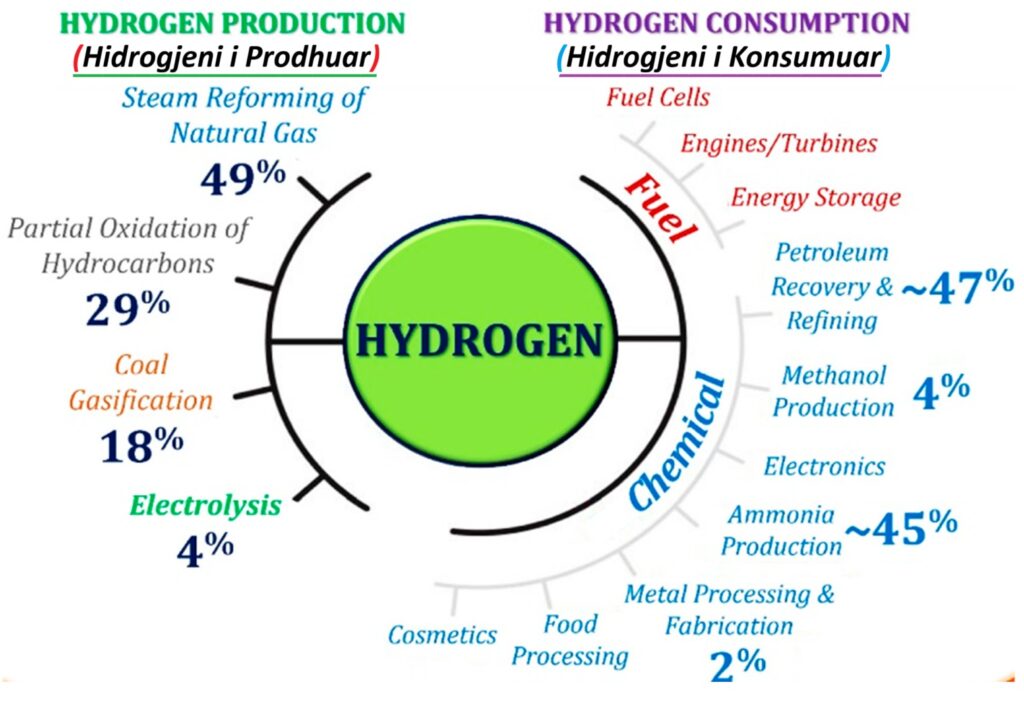
Hidrogjeni i Prodhuar dhe Hidrogjeni i Konsumuar – ilustrim1a
E ardhmja e hidrogjenit
Hidrogjeni mund të përdoret për të fuqizuar automjetet, për të gjeneruar energji elektrike, për të energjizuar industrinë dhe për të ngrohur shtëpitë dhe bizneset tona. Mund të bëjë një ndryshim të madh në emetimet tona të karbonit dhe do të jetë kritike për arritjen e zeros neto.]6
Hidrogjeni është gjithashtu një opsion emocionues i karburantit të lehtë për transportin rrugor, ajror dhe sanitar. Kompania ndërkombëtare e shpërndarjes DHL tashmë ka një flotë ‘furgonësh me panel H2’, të aftë për të udhëtuar 500 km pa karburant.
Që hidrogjeni të jetë një alternativë e qëndrueshme ndaj metanit, ai duhet të prodhohet në shkallë, ekonomikisht dhe infrastruktura aktuale duhet të përshtatet.
–
Referenca



