Allotropia është vetia e disa elementeve kimike që ekzistojnë në dy ose më shumë forma të ndryshme, në të njëjtën gjendje fizike, të njohura si alotrope të elementeve. Allotropia është një fenomen kimik në të cilin i njëjti element kimik mund të ekzistojë në forma të ndryshme alotropike, domethënë struktura të ndryshme kristalore. Këto forma të ndryshme alotropike kanë veti të dallueshme fizike dhe kimike, duke rezultuar në sjellje të ndryshme të elementit në fjalë.
Allotropia është fenomeni në të cilin një element kimik mund të ekzistojë në forma të ndryshme alotropike, domethënë struktura të ndryshme, edhe pse formohet nga të njëjtat atome. Kjo është për shkak të rregullimit të atomeve në strukturën molekulare, të cilat mund të ndryshojnë dhe të rezultojnë në veti të dallueshme fizike dhe kimike.
Allotropia, e njohur gjithashtu si allotropizëm, i referohet fenomenit shkencor në të cilin një element mund të ekzistojë në forma të shumta fizike të dallueshme si dhe struktura. Allotropet janë forma të dallueshme të një elementi që shfaqin forma të ndryshme fizike. Allotropia është një fenomen i vërejtur për elementë të veçantë kimikë, në të cilin ata kanë aftësinë për të qenë të pranishëm në dy ose më shumë forma të dallueshme.
Historia e allotropisë (1)
Koncepti i alotropisë u propozua fillimisht në 1840 nga shkencëtari suedez Baron Jöns Jakob Berzelius (1779–1848). Termi rrjedh nga greqishtja άλλοτροπἱα (allotropia) ‘ndryshueshmëri, ndryshueshmëri’. Pas pranimit të hipotezës së Avogadro në 1860, u kuptua se elementët mund të ekzistonin si molekula poliatomike dhe dy alotrope të oksigjenit u njohën si O2 dhe O3. Në fillim të shekullit të 20-të, u njoh se raste të tjera si karboni ishin për shkak të ndryshimeve në strukturën kristalore.
Deri në vitin 1912, Ostwald vuri në dukje se alotropia e elementeve është vetëm një rast i veçantë i fenomenit të polimorfizmit të njohur për komponimet dhe propozoi që termat alotrop dhe alotropi të braktisen dhe të zëvendësohen nga polimorfi dhe polimorfizëm. Megjithëse shumë kimistë të tjerë e kanë përsëritur këtë këshillë, IUPAC2 dhe shumica e teksteve të kimisë ende favorizojnë përdorimin e alotropit dhe alotropisë vetëm për elementet.
Allotropia, ekzistenca e një elementi kimik në dy ose më shumë forma, të cilat mund të ndryshojnë në rregullimin e atomeve në lëndë të ngurta kristalore ose në shfaqjen e molekulave që përmbajnë numër të ndryshëm atomesh. Ekzistenca e formave të ndryshme kristalore të një elementi është i njëjti fenomen që në rastin e komponimeve quhet polimorfizëm. Allotropet mund të jenë monotropike, në këtë rast një nga format është më e qëndrueshme në të gjitha kushtet, ose enantiotropike, në këtë rast forma të ndryshme janë të qëndrueshme në kushte të ndryshme dhe i nënshtrohen tranzicioneve të kthyeshme nga njëra në tjetrën në temperatura dhe presione karakteristike. (3)
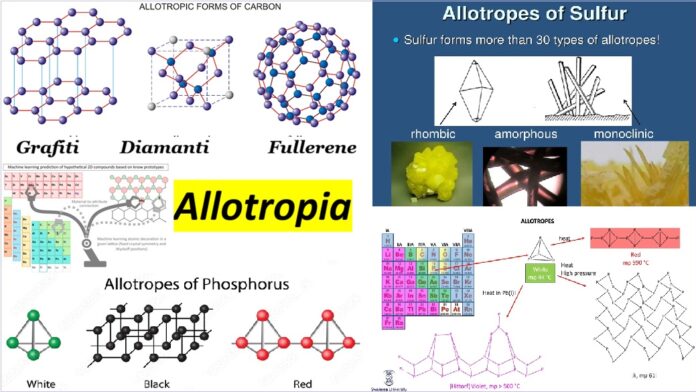
Elementet që shfaqin alotropi përfshijnë kallajin, karbonin, squfurin, fosforin dhe oksigjenin. Kallaji dhe squfuri janë enantiotropike. E para ekziston në një formë gri, e qëndrueshme nën 13.2 °C, dhe një formë e bardhë, e qëndrueshme në temperatura më të larta. Squfuri formon kristale rombike, të qëndrueshme nën 95.5 °C, dhe kristale monoklinike, të qëndrueshme midis 95.5 °C dhe pikës së shkrirjes (119 °C). Karboni, fosfori dhe oksigjeni janë monotropik. Grafiti është më i qëndrueshëm se diamanti, fosfori i kuq është më i qëndrueshëm se i bardhi dhe oksigjeni diatomik, që ka formulën O2, është më i qëndrueshëm se oksigjeni triatomik (ozoni, O3) në të gjitha kushtet e zakonshme.
Allotropia: Transformimi allotropik dhe elementët kryesorë(4)
Allotropia është një fenomen kimik në të cilin i njëjti element kimik mund të ekzistojë në forma të ndryshme allotropike, domethënë struktura të ndryshme kristalore. Këto forma të ndryshme allotropike kanë veti të dallueshme fizike dhe kimike, duke rezultuar në sjellje të ndryshme të elementit në fjalë. Në këtë kontekst, ky tekst do të trajtojë transformimin allotropik dhe elementët kimikë më të njohur për paraqitjen e këtij fenomeni, duke theksuar karakteristikat dhe aplikimet e tyre.
Allotropia është një fenomen i zakonshëm në natyrë, ku një element kimik mund të ekzistojë në forma të ndryshme alotropike. Këto forma alotropike kanë veti të dallueshme fizike dhe kimike, duke i bërë ato unike dhe interesante për t’u studiuar.
Elementet allotrope janë forma të ndryshme fizike të të njëjtit element kimik, domethënë kanë të njëjtën përbërje kimike, por struktura të ndryshme. Këto ndryshime në strukturën e elementeve alotrope rezultojnë në veti të dallueshme fizike dhe kimike.
Allotropia në kimi është karakteristika që kanë disa elementë kimikë kur paraqiten në disa forma të ndryshme, por në të njëjtën gjendje grumbullimi të materies. Struktura e elementeve mund të ndryshojë në varësi të rregullimit të tyre molekular dhe kushteve në të cilat ato formohen, si presioni dhe temperatura.
Vetëm kur bëhet fjalë për elementet kimike përdoret fjala allotropi, secila nga mënyrat në të cilat mund të gjendet një element në të njëjtën fazë përcaktohet si një allotrop; ndërsa për komponimet që shfaqin struktura të ndryshme kristalore, nuk zbatohet; Në këtë rast, quhet polimorfizëm.
Format kryesore allotropike në natyrë
Një nga elementët më të njohur për paraqitjen e formave të ndryshme alotropike është karboni. Karboni mund të gjendet në natyrë në tre forma kryesore alotropike: diamant, grafiti dhe fullereni.
Diamanti është i njohur për fortësinë dhe shkëlqimin e tij dhe përdoret në bizhuteri dhe industrinë e prerjes dhe lustrimit. Grafiti, nga ana tjetër, është i njohur për butësinë e tij dhe për të qenë një përcjellës i shkëlqyer i energjisë elektrike, duke u përdorur në lapsa dhe aplikacione elektronike. Së fundi, fullereni është një formë alotropike e zbuluar së fundmi, duke qenë i njohur për strukturën e tij të kafazit të karbonit dhe për aplikimet e tij në nanoteknologji.
Këto forma të ndryshme alotropike të karbonit janë për shkak të rregullimit të atomeve të karbonit në strukturat e tyre kristalore. Në diamant, atomet e karbonit janë të rregulluara në një strukturë kub tredimensionale, ndërsa në grafit, ato formojnë shtresa të sheshta gjashtëkëndore.
Është e rëndësishme të theksohet se transformimi alotropik nuk përfshin një ndryshim në përbërjen kimike të elementit, vetëm në rregullimin e atomeve në strukturën e tij. Prandaj, alotropet e të njëjtit element kanë veti të ndryshme, gjë që i bën ato të dobishme në aplikime të ndryshme teknologjike dhe industriale.
Përveç karbonit, edhe elementë të tjerë kanë forma alotropike. Oksigjeni, për shembull, mund të gjendet në natyrë si oksigjen molekular (O2) dhe ozon (O3). Ndërsa oksigjeni molekular është thelbësor për frymëmarrjen aerobike, ozoni është i njohur për aftësinë e tij për të filtruar rrezatimin ultravjollcë në atmosferë. Oksigjeni, në të cilat alotropia mund të ndodhë si një ndryshim në numrin e atomeve në substancë. Në këtë kuptim, ekziston nocioni i dy alotropeve të këtij elementi, i njohur më mirë si oksigjen (O2) dhe ozoni (O3).
Transformimi allotropik
Siç u përmend më herët, alotropet janë mënyrat e ndryshme në të cilat mund të gjendet i njëjti element; Prandaj, ky ndryshim në strukturën e tyre bën që këto specie të kenë karakteristika të ndryshme fizike dhe kimike.
Përveç kësaj, transformimi alotropik midis një elementi dhe tjetrit jepet nga mënyra se si atomet renditen brenda molekulave; domethënë, mënyra në të cilën lidhja e ka origjinën.
Ky ndryshim midis një alotropi dhe tjetrit mund të ndodhë për arsye të ndryshme, të tilla si ndryshimet në kushtet e presionit, temperatura dhe madje edhe incidenca e rrezatimit elektromagnetik, siç është drita.
Kur struktura e një specie kimike ndryshohet, ajo gjithashtu mund të ndryshojë sjelljen e saj, duke modifikuar vetitë si përçueshmëria elektrike, fortësia (në rastin e substancave të ngurta), pika e shkrirjes ose vlimit dhe madje edhe cilësitë fizike si ngjyra e saj.
Përveç kësaj, allotropia mund të jetë e dy llojeve:
– Monotropik, kur njëra nga strukturat e elementit ka stabilitet më të madh se të tjerat në të gjitha kushtet.
– Enantropike, kur strukturat e ndryshme janë të qëndrueshme në kushte të ndryshme, por mund të transformohen në mënyrë të kthyeshme me njëra-tjetrën në presione dhe temperatura të caktuara.
Allotropet e disa elementeve
Elementet në tabelën periodike, jo të gjithë kanë forma alotropike. Më poshtë janë disa elementët më të njohur allotropik.
Karboni
Ky element me bollëk të madh në natyrë përfaqëson bazën themelore të kimisë organike. Njihen disa lloje allotropike të kësaj, ndër të cilat diamanti, grafiti dhe të tjerët që do të ekspozohen më poshtë.
Diamant: Diamanti tregon një rregullim molekular në formën e kristaleve tetraedrike, atomet e të cilave janë të lidhura me lidhje të vetme; Kjo do të thotë se ato organizohen nga hibridizimi PS3.
Grafiti: Grafiti formohet nga fletë të njëpasnjëshme karboni, ku atomet e tij janë të lidhura në struktura gjashtëkëndore me lidhje të dyfishta; Kjo është e hibridizuar PS2.
Karabina: Përveç dy alotropeve të rëndësishme të përmendura më lart, të cilat janë më të njohurat e karbonit, ka edhe të tjera, të tilla si karabina (siç njihet edhe si karboni linear i acetilenit, LAC), ku atomet e saj janë rregulluar në mënyrë lineare me anë të lidhjeve të trefishta; domethënë me hibridizimin e SP.
Grafeni: struktura e të cilit është shumë e ngjashme me atë të grafitit
Fullerene: ose buckminsterfullerene, i njohur gjithashtu si buckybalon, struktura e të cilit është gjashtëkëndore, por atomet e tij janë të rregulluara në formën e një unaze.
Nanotuba karboni: cilindrikë.
Karbon amorf: pa strukturë kristalore.
Squfuri
Squfuri gjithashtu ka disa alotrope që konsiderohen të zakonshme, si më poshtë (duhet theksuar se të gjitha janë në gjendje të ngurtë):
Squfuri rombik: Siç nënkupton edhe emri, struktura e tij kristalore formohet nga rombet tetëkëndore dhe njihet edhe si α-squfur.
Squfuri monoklinik: I njohur si β squfuri, ka formën e një prizmi të përbërë nga tetë atome squfuri.
Squfuri i shkrirë: Ajo krijon kristale prizmatike që janë të qëndrueshme në temperatura të caktuara, duke formuar gjilpëra që nuk kanë ngjyrë.
Squfur plastik: I quajtur edhe squfur, ka një strukturë amorfe.Squfur i lëngshëm: Ka karakteristika viskoziteti në kundërshtim me shumicën e elementeve, sepse në këtë allotrop rritet me rritjen e temperaturës.
Fosfori
Ky element jometalik zakonisht gjendet në natyrë në kombinim me elementë të tjerë dhe ka disa substanca allotropike të lidhura:
Fosfori i bardhë: Është një trup i ngurtë me një strukturë kristalore në formë tetraedri dhe ka aplikime në fushën ushtarake, madje përdoret si armë kimike.
Fosfori i zi: Ka stabilitetin më të lartë midis allotropeve të këtij elementi dhe është shumë i ngjashëm me grafenin.
Fosfori i kuq: Formon një lëndë të ngurtë amorfe me veti reduktuese, por pa toksicitet.
Difosfori: Siç nënkupton emri, ai përbëhet nga dy atome fosfori dhe është një formë e gaztë e këtij elementi
Ndarje vjollce: Është një strukturë e fortë kristalore me një rregullim molekular të tipit monoklinik.
Fosfori i kuq i ndezur: Struktura amorfe është gjithashtu e fortë.
Oksigjeni
Pavarësisht se është një nga elementët më të zakonshëm në atmosferën e Tokës dhe një nga elementët më të bollshëm në univers, ai ka pak alotrope të njohura, ndër të cilat dallohen dioksigjeni dhe trioksigjeni.
Dioksigjen: Dioksigjeni njihet më mirë me emrin e thjeshtë të oksigjenit, një substancë e gaztë thelbësore për proceset biologjike të këtij planeti.
Trioksigjen: Triioxigen njihet më mirë thjesht si ozoni, një allotrop shumë reaktiv, funksioni më i famshëm i të cilit është të mbrojë atmosferën e Tokës nga burimet e jashtme të rrezatimit.
Tetraoksigjeni: Ajo formon një fazë të fortë të strukturës trekëndore me karakteristika metastabiliteti.
Të tjera: Dallohen gjithashtu gjashtë specie të tjera të ngurta që formojnë oksigjen, me struktura të ndryshme kristalore.
Po kështu, ka elementë të tillë si seleni, bori, silikoni, ndër të tjera, të cilët kanë alotrope të ndryshme dhe janë studiuar në thellësi më të madhe ose më të vogël.
Përmbledhje
Format allotropike të elementeve në natyrë janë magjepsëse për diversitetin e vetive që paraqesin. Studimi i këtyre formave alotropike na lejon të kuptojmë më mirë kiminë dhe fizikën e elementeve dhe të eksplorojmë aplikime të reja në fusha të ndryshme.
Kuptimi i allotropeve është jashtëzakonisht i rëndësishëm në kiminë moderne, pasi lejon zhvillimin e materialeve të reja me veti specifike për aplikime të ndryshme. Përveç kësaj, studimi i allotropeve kontribuon në avancimin e nanoteknologjisë dhe shkencës së materialeve.
Allotropia është një fenomen që lejon ekzistencën e formave të ndryshme të të njëjtit element kimik, siç është rasti i karbonit me allotropet e tij diamant, grafiti dhe fullereni, secili me veti unike dhe aplikime specifike në kimi dhe industri.
Prandaj, hetimi dhe kuptimi i allotropeve janë thelbësore për përparimin e kimisë dhe për krijimin e materialeve inovative dhe teknologjikisht të avancuara.
–
Referencat