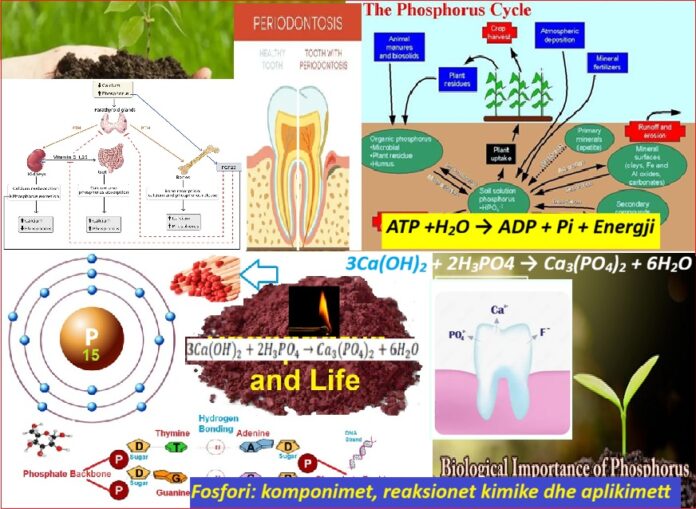
Fosfori është një element jometalik që është një bllok thelbësor për ndërtimin e jetës. Ai mban numrin atomik 15 në tabelën periodike dhe përfaqësohet nga simboli ‘P’ (Phosphorus).
– Ky element luan një rol vendimtar në procese të ndryshme biokimike, duke përfshirë formimin e ADN-së dhe ARN-së, si dhe transferimin e energjisë në qeliza. Komponimet e tij përdoren gjithashtu gjerësisht në plehra, detergjentë dhe madje edhe fishekzjarre.
Si jometal, fosfori përgjithësisht ekziston në formë të ngurtë dhe nuk është një përcjellës i mirë i energjisë elektrike.
Nga: chemistrycool.com> [Phosphorus: Element 15’s Uses, Chemical Reactions, and Applications]1
Sfondi historik
– Fosfori u zbulua në 1669 nga alkimisti gjerman Hennig Brand.
– Brand zbuloi fosforin ndërsa po distilonte urinën në një përpjekje për të krijuar gurin filozofik – një substancë mitike që thuhej se i kthente metalet bazë në ar.
– Emri “fosfor” e ka origjinën nga fjalët greke “phos” dhe “phoros”, që do të thotë “sjellës i dritës”, pasi shkëlqen në errësirë kur ekspozohet ndaj oksigjenit.
Vetitë fizike
- – Pesha atomike: 30.973761998
- – Pika e shkrirjes: 44.15°C
- – Pika e vlimit: 280.5°C
- – Dendësia: 1.82 g/cm³ (fosfor i bardhë)
- – Ngjyra: Ndryshon me alotropet (e bardhë, e kuqe, e zezë)
- – Gjendja në temperaturën e dhomës: E ngurtë
- – Përçueshmëria elektrike: Përcjellës i dobët
- – Vetitë magnetike: Diamagnetike
- – Izotopet: P-31 është izotopi më i qëndrueshëm
- – Karakteristika të tjera fizike të dukshme: Ekziston në disa forma alotropike duke përfshirë fosforin e bardhë, të kuq dhe të zi, secila me veti unike.

Tri alotropet e fosforit – imazh1a
Vetitë kimike
Konfigurimi i elektroneve
Fosfori ka një konfigurim elektronik prej [Ne] 3s² 3p³. Ky konfigurim na tregon se fosfori ka 5 elektrone valence – dy në orbitalin 3s dhe tre në orbitalin 3p. Kjo strukturë është kritike për të kuptuar modelet e reaktivitetit dhe lidhjes së elementit. Zakonisht formon komponime kovalente duke ndarë elektronet e tij të valencës, megjithëse mund të formojë edhe komponime jonike.
Gjendjet e oksidimit
Fosfori shfaq gjendje të shumta oksidimi, duke përfshirë -3, +1, +3 dhe +5. Gjendjet më të zakonshme të oksidimit janë +3 dhe +5, të cilat zakonisht shihen në komponime si acidi fosforik (H₃PO₄) dhe kripërat e tij. Në kiminë organike, fosfori shpesh ekziston në një gjendje oksidimi prej -3, si në fosfinat (PH₃) dhe në biomolekula të rëndësishme si ATP (Adenosine triphosphate).
Komponimet e zakonshme
- Acidi fosforik (H₃PO₄): Ky është ndoshta përbërësi më i përdorur i fosforit. Përdoret gjerësisht në plehra dhe detergjentë.
- Fosfati i kalciumit (Ca₃(PO₄)₂): Ky përbërës gjendet në kocka dhe dhëmbë dhe përdoret gjithashtu në plehra.
- Fosfina (PH₃): Ky është një gaz shumë toksik që përdoret në industrinë e gjysmëpërçuesve dhe si fumigant për drithërat e ruajtura.
- Pentoksi i fosforit (P₄O₁₀): Ky tharës i fuqishëm përdoret në aplikime industriale për heqjen e gjurmëve të ujit.
Reaksione kimike të dukshme
- Djegia në ajër
Një nga reaksionet më të shquara që përfshin fosforin është djegia e tij në prani të oksigjenit. Kjo është veçanërisht e vërtetë për fosforin e bardhë, i cili mund të ndizet spontanisht pas ekspozimit ndaj ajrit.
P4 + 5O2 → P4O10
Ose,
4P + 5O2 → 2P2O5
Reaksioni prodhon pentoksid fosfori (P₄O₁₀), i cili është një agjent i fuqishëm dehidratues që përdoret në një sërë aplikimesh, duke përfshirë si një agjent tharjeje për gazrat dhe tretësit, dhe në sintezën organike. Mund të reagojë më tej me ujin për të formuar acid fosforik:
P4O10 + 6H2O → 4H3PO4
Ky reaksion është shumë ekzotermik, duke çliruar një sasi të konsiderueshme energjie në formën e nxehtësisë dhe dritës.
- Reagimi me ujë
Fosfori i bardhë është shumë reaktiv dhe madje mund të reagojë me ujin, megjithëse më ngadalë në krahasim me reagimin e tij me oksigjenin. Ky reaksion prodhon fosfinë, një gaz toksik dhe të ndezshëm, dhe acid fosforik.
2P4 + 12H2O → 5PH3 + 3H3PO4
Fosfina e prodhuar (PH₃) është e ndezshme dhe mund të formojë përzierje shpërthyese në ajër. Përdoret industrialisht në sektorin e gjysmëpërçuesve dhe si fumigant për drithërat e ruajtura. Megjithatë, për shkak të toksicitetit të tij, duhet të trajtohet me kujdes ekstrem.
- Formimi i fosfateve
Fosfori reagon lehtësisht me elementë të ndryshëm për të krijuar një sërë fosfatesh. Këto komponime janë thelbësore si në sistemet biologjike ashtu edhe në bujqësi, kryesisht si plehra.
Formimi i fosfatit të kalciumit, për shembull, është thelbësor për ngurtësimin e kockave dhe dhëmbëve:
3Ca(OH)2 + 2H3PO4 →Ca3(PO4)2 + 6H2O
Formimi i fosfateve shpesh përfshin reaksione acid-bazë me acid fosforik (H₃PO₄), duke çuar në forma të ndryshme të kripërave fosfatike. Këto kripëra mund të veprojnë si tampon në sistemet biologjike dhe si lëndë ushqyese në tokë.
- Reaksionet biologjike
Në qelizat e gjalla, reaksioni kimik më i dukshëm që përfshin fosforin është formimi dhe hidroliza e trifosfatit të adenozinës (ATP). ATP shërben si një “monedhë energjie” celulare.
Ekuacioni kimik për hidrolizën ATP
ATP +H2O → ADP + Pi + Energy
Hidroliza e ATP çliron energji që qeliza mund ta përdorë për funksione të ndryshme, duke përfshirë lëvizjen, transduksionin e sinjalit dhe anabolizmin. Fosfati inorganik (Pi) i lëshuar në këtë reaksion shpesh riciklohet përsëri në ATP.
Bollëku dhe burimet
– Fosfori nuk gjendet lirshëm në natyrë për shkak të reaktivitetit të tij të lartë.
– Është elementi i 11-të më i bollshëm në koren e Tokës.
– Mineralet e zakonshme përfshijnë apatitin dhe fosforitin.
– Izolohet kryesisht përmes nxjerrjes së shkëmbinjve fosfat; mund të nxirret gjithashtu nga guano, hiri i kockave dhe burime të tjera natyrore.
Përdorimet dhe aplikimet
Përdorimet industriale
- Plehrat: Përdorimi më i rëndësishëm industrial i fosforit është në prodhimin e plehrave. Fosfori është një nga tre lëndët ushqyese kryesore thelbësore për rritjen e bimëve, dy të tjerët janë azoti dhe kaliumi. Plehrat e fosforit shpesh vijnë në formën e fosfatit të amonit, superfosfatit dhe superfosfatit të trefishtë.
- Detergjentët: Fosfatet, veçanërisht tripolifosfati i natriumit, shtohen në detergjentë për të zbutur ujin dhe për të përmirësuar pastrimin. Megjithatë, përdorimi i tyre është kufizuar në disa rajone për shkak të shqetësimeve mjedisore.
- Trajtimi i ujit: Komponimet e fosforit përdoren në trajtimin e ujit për të kontrolluar algat dhe për të hidratuar llumin. Ato shërbejnë gjithashtu si rregullues të pH dhe frenues të korrozionit.
- Siguria nga zjarri: Disa komponime fosfori përdoren si retardantë të flakës në tekstile, plastikë dhe veshje. Këto komponime ndërpresin procesin e djegies, duke zvogëluar rrezikun e përhapjes së zjarrit.
Aplikimet mjekësore
- Kujdesi dentar: Fosfati i kalciumit është një përbërës kyç në disa formulime të pastave të dhëmbëve, duke promovuar rimineralizimin dhe forcimin e smaltit.
- Transplantet e kockave: Qeramika biokompatibële e fosfatit të kalciumit përdoret në aplikimet e transplantit të kockave. Ato nxisin rigjenerimin e kockave dhe resorbohen nga trupi me kalimin e kohës.
- Suplementet: Disa suplemente kalciumi dhe fosfori janë të disponueshme për trajtimin e kushteve të caktuara mjekësore, të tilla si hipofosfatemia – një mungesë e fosforit në gjak.
Përdorimet e përditshme
- Industria ushqimore: Acidi fosforik përdoret si një shtesë ushqimore për të acidifikuar ushqimet dhe pijet si soda. Për më tepër, disa mish dhe djathëra të përpunuar përdorin fosfate si stabilizues dhe emulsikues.
- Produktet e pastrimit: Fosfatet gjenden në produktet e pastrimit shtëpiak, duke përfshirë detergjentët për larjen e enëve dhe pastrues sipërfaqesh, për vetitë e tyre zbutëse të ujit dhe prerjes së yndyrës.
- Ndeshjet dhe fishekzjarrët: Komponimet e fosforit janë pjesë integrale e kokave të ndeshjeve të sigurisë dhe formulimeve të disa fishekzjarreve, duke shërbyer si ndezës dhe ngjyrues.
Rëndësia në sistemet biologjike
- Formimi i ADN/ARN-së: Fosfori është thelbësor në formimin e shtyllës kurrizore të molekulave të ADN-së dhe ARN-së, duke luajtur një rol kritik në ruajtjen dhe transmetimin e informacionit gjenetik.
- Transferimi i energjisë: Si një komponent kryesor i ATP (adenozina trifosfat), fosfori është thelbësor për ruajtjen dhe transferimin e energjisë brenda qelizave.
- Sistemi nervor: Komponimet e fosforit janë përbërës jetik të qelizave nervore dhe janë thelbësore për transmetimin e sinjalit nervor.
- Membranat qelizore: Fosfori është një pjesë kyçe e fosfolipideve, të cilat përbëjnë membranat qelizore. Këto membrana janë thelbësore për mbrojtjen e qelizës dhe kontrollin e kalimit të substancave brenda dhe jashtë.
Siguri
– Nivelet e toksicitetit: Fosfori i bardhë është shumë toksik; format e kuqe dhe të zeza janë shumë më pak toksike.
– Masat paraprake për të trajtuar elementin: Duhet të ruhet nën ujë ose në gazra inerte për të parandaluar kontaktin me ajrin, pasi mund të ndizet spontanisht.
– Udhëzimet e ruajtjes: Mbajeni në një zonë të freskët, të ajrosur mirë, larg burimeve të ndezjes dhe oksiduesve të fortë.
Fakte interesante
– Fosfori ishte elementi i parë që u zbulua që nuk njihej që nga kohërat e lashta.
– Shkëlqimi i fosforit është për shkak të një fenomeni të njohur si kimilumineshencë.
– Fosfori është një element kyç në shumë pesticide dhe herbicide.
– Mbi 90% e fosforit të minuar përdoret në prodhimin e plehrave.
Përfundim – Fosfori është një element intrigues dhe shumëplanësh me një histori të pasur dhe gamë të larmishme aplikimesh. Vetitë e tij e bëjnë atë jetik si për sistemet biologjike ashtu edhe për industri të ndryshme. Historia e tij – nga zbulimi i tij alkimik deri te përdorimet e tij moderne – nxjerr në pah rëndësinë e tij të qëndrueshme në shkencë dhe jetën e përditshme. Qoftë duke ndriçuar natën si “sjellës i dritës” ose duke ndihmuar në rritjen e bimëve, fosfori vazhdon të jetë një element me ndikim të rëndësishëm.
–
Referencat