Në kimi, ligji i përmasave të përcaktuara, i quajtur ndonjëherë ligji i Proustit ose ligji i përbërjes konstante, pohon se një përbërje kimike e caktuar gjithmonë përmban elementet përbërëse të tij në raport fiks (sipas masës) dhe nuk varet nga burimi dhe metoda e përgatitjes së tij.
Për shembull, oksigjeni përbën rreth 8/9 e masës së çdo mostre të ujit të pastër, ndërsa hidrogjeni përbën 1/9 e mbetur të masës: masa e dy elementeve në një përbërje janë gjithmonë në të njëjtin raport.
Së bashku me ligjin e proporcioneve të shumta, ligji i përmasave të përcaktuara formon bazën e stekiometrisë (stoichiometry).
Një nga pjesët më të rëndësishme të kimisë është stekiometria.
Stekiometria është marrëdhënia midis peshave të reaktantëve dhe produkteve para, gjatë dhe pas reaksioneve kimike.
Stekiometria (Stoichiometry /stˈkiˈmיtri/).) është studimi i sasisë së reaktantëve dhe produkteve në një reaksion kimik. Fjala vjen nga fjalët greke: stoicheion (“element”) dhe metron (“masë”). Ndonjëherë do të shihni stoichiometry mbuluar nga një emër tjetër: marrëdhëniet masive. Është një mënyrë më e lehtë për të thënë të njëjtën gjë. (1)
Ligji i përmasave konstante ose Ligji i proporcioneve konstante thotë se komponimet kimike janë të përbëra nga elemente që janë të pranishme në një raport fiks sipas masës.
Ligji i përmasave konstante shpesh quhet ligji i Proustit ose si Ligji i përmasave të përcaktuara.
Çdo mostër e pastër e një komponimi, pavarësisht nga burimi, do të përbëhet gjithmonë nga të njëjtat elemente që janë të pranishme në të njëjtin raport sipas masës.
Për shembull, uji i pastër do të përmbajë gjithmonë hidrogjen dhe oksigjen në një raport të masës fikse (një gram ujë përbëhet nga rreth 0.11 gram hidrogjen dhe 0.88 gram oksigjen, raporti është 1:8).
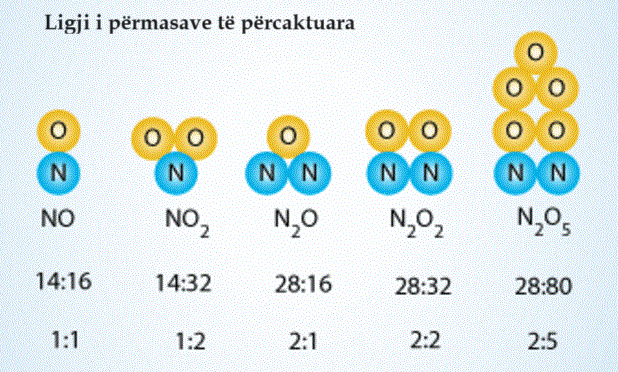
Një ilustrim që përshkruan raportin e masës së elementeve në disa komponime është dhënë më poshtë. Raporti i numrit të atomeve të çdo elementi është dhënë nën raportin e masës. Për shembull, në një dioksid azoti (NO2) molekula, raporti i numrit të atomeve të azotit dhe oksigjenit është 1:2 por raporti i masës është 14:32 (ose 7:16).
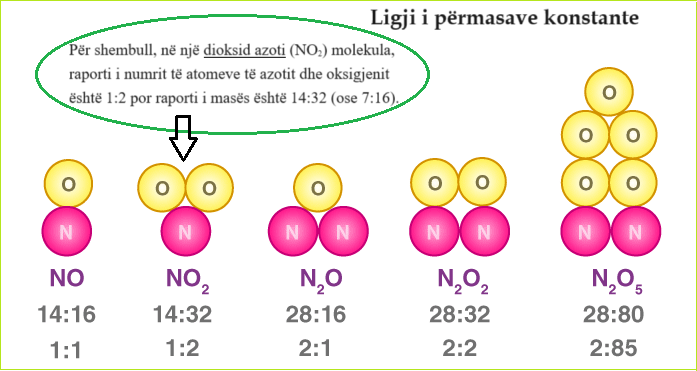
imazh1 (2)
Në vitin 1794, kimisti francez Joseph Proust formuloi ligjin me përmasa konstante nga puna e tij mbi sulfatet, oksidet metalike dhe sulfatet. Ky ligj u prit me shumë kundërshtime në komunitetin shkencor në shekullin e 18-të. Futja e teorisë atomike të Dalton favorizoi këtë ligj dhe një marrëdhënie midis këtyre dy koncepteve u krijua nga kimisti suedez Jacob Berzelius në vitin 1811.
Ligji i përmasave të përcaktuara, pohimi se çdo përbërje kimike përmban përmasa fikse dhe konstante (sipas masës) të elementeve përbërëse të tij. Edhe pse shumë eksperimentues kishin marrë prej kohësh të vërtetën e parimit në përgjithësi, kimisti francez Joseph-Louis Proust grumbulloi për herë të parë prova përfundimtare për të në një seri kërkimesh mbi përbërjen e shumë substancave, veçanërisht oksidet e hekurit (1797). Një tjetër kimist francez, Claude Berthollet, i cili mbajti për përmasa të pacaktuara, kundërshtoi gjetjet e Proust, por kimisti skocez Thomas Thomson konfirmoi disa prej tyre dhe shkroi në artikullin e tij “Kimi” në Suplementin e Encyclopædia Britannica (1801) se Proust kishte provuar përfundimisht se “metalet nuk janë të afta për shkallë të pacaktuar të oksidimit”. Parimi pastaj u formulua në mënyrë konkrete nga kimisti anglez John Dalton në teorinë e tij atomike kimike (1808). (3)
Cilat janë përjashtimet e ligjit me përmasa konstante?
Pavarësisht se është një bllok ndërtimi në zhvillimin e kimisë, ligji i përmasave konstante nuk është i vërtetë për të gjitha komponimet kimike. Disa përjashtime të këtij ligji janë renditur më poshtë.
Disa komponime jo-stoichiometrike kanë përbërje të ndryshme të elementeve midis mostrave. Këto komponime i binden ligjit të përmasave të shumta në vend të kësaj. Një shembull i tillë është wustite, një oksid hekuri me formulën kimike FeO. Raporti i atomeve të hekurit dhe oksigjenit mund të variojë nga 0.83:1 deri në 0.95:1. Kjo shkaktohet nga vendet e lira kristalografike në mostrat e shkaktuara nga një rregullim i çrregullt i atomeve.
Mostra të ndryshme të një komponimi mund të ndryshojnë në përbërjen izotopike të elementeve përbërëse të tij. Kjo mund të çojë në luhatje në raportet e masës. Dallimet në raportet e masës midis mostrave janë shumë të dobishme në procesin e datimit gjeokimik, për shkak të përqendrimit preferencial të izotopeve në shumë procese të thella të Tokës dhe kores toksore. Kjo ndodh edhe në shumë procese oqeanike, atmosferike e madje edhe astronomike. Pavarësisht se efektet janë mjaft të vogla, sfidat në matjen e efekteve janë kapërcyer nga instrumentimi modern.
Meqë polimerët natyrorë mund të ndryshojnë në përbërjet e tyre, mostra të ndryshme mund të tregojnë përmasa të ndryshme në masë.
Pyetje që bëhen shpesh mbi ligjin me përmasa konstante
Pyetje 1: Cili është pohimi i ligjit me përmasa të përcaktuara?
Ligji i përmasave të përcaktuara, i njohur edhe si ligji i përmasave konstante, thotë se elementet individuale që përbëjnë një përbërje kimike janë gjithmonë të pranishëm në një raport fiks (përsa i përket masës së tyre). Ky raport nuk varet nga burimi i përbërjes kimike apo metoda përmes së cilës është përgatitur.
Pyetje 2: Cilat janë përjashtimet e ligjit me përmasa konstante?
Raporti i elementeve në komponimet jo-stoichiometrike ndryshon nga mostra në mostër. Prandaj, këto komponime janë një përjashtim nga ligji me përmasa konstante. Mostrat e elementeve që ndryshojnë në përbërjen e tyre izotopike mund të sfidojnë edhe ligjin e përmasave të përcaktuara pasi masat e dy izotopeve të ndryshme të një elementi janë të ndryshme. Polimerët natyrorë njihen gjithashtu se nuk i binden ligjit me përmasa konstante.
Pyetje 3: Kush e teorizoi ligjin me përmasa të përcaktuara?
Ligji me përmasa të përcaktuara u paraqit për herë të parë nga kimisti francez Joseph Louis Proust në vitin 1779. Kjo është arsyeja pse ky ligj njihet edhe si ligji i Proustit. Vëzhgimet e lidhura me këtë ligj u bënë për herë të parë nga kimistët francezë Antoine Lavoisier dhe Joseph Priestley.
Pyetje 4: Jepni disa shembuj të komponimeve që i binden ligjit me përmasa të përcaktuara.
Molekulat e ujit paraqesin kombinimet e atomeve të hidrogjenit dhe oksigjenit në një raport 2:1. Meqë janë të pranishme në një raport fiks të masës, molekulat e ujit i binden ligjit me përmasa konstante. Një shembull tjetër i një komponimi kimik që i bindet ligjit me përmasa konstante është metani. Për të formuar një molekulë metan, 4 atome hidrogjeni kombinohen me 1 atom karboni.
Pyetje 5: Cila është domethënia e ligjit me përmasa të përcaktuara?
Edhe pse ky ligj është lehtësisht i kuptueshëm sot, ai ishte me përdorim të madh në fund të shekullit të 18-të kur komponimet kimike nuk kishin ndonjë përkufizim të duhur. Ligji i përmasave të përcaktuara gjithashtu kontribuoi në zhvillimin e teorisë atomike të Daltonit.
Pyetje 6: A është i vërtetë ligji me përmasa konstante?
Jo, për të gjitha format e substancave, ligji me proporcion të caktuar nuk është i vlefshëm. Elementet me një përzierje izotopike të qëndrueshme shpesh formojnë një produkt jo-stoichiometrik. Roli i disa elementeve në strukturën e kristalit zëvendësohet nga izotopet e tyre që nxisin përbërjen e brendshme të kristalit të ndryshojë.
Pyetje 7: Cili postulat i teorisë së Daltonit ishte i saktë?
Pandashmëria e një atomi është provuar e gabuar: është e mundur të ndahet më tej një atom në protone, neutrone dhe elektrone. Megjithatë, grimca më e vogël që ndodh në reaksionet kimike është një elektron. Atomet e të njëjtit produkt janë identike në të gjitha aspektet, sipas Dalton.
etj.
–
Reference: