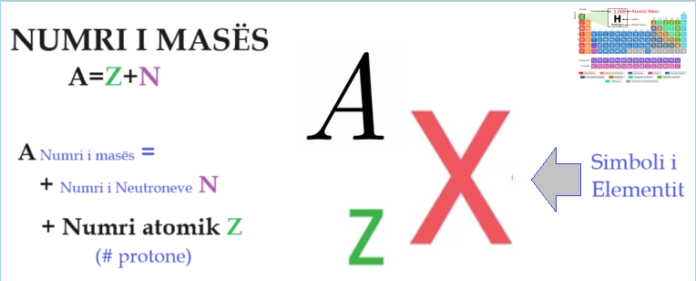Numri i masës (A) përkufizohet si numri i përgjithshëm i protoneve dhe neutroneve në një atom. Mund të llogaritet duke mbledhur së bashku numrin e neutroneve dhe numrin e protoneve (numri atomik).
A=Z+N (Numri i masës = numri atomik + numri i neutroneve)
Numri i masës është shkruar ose pas emrit të elementit ose si një mbishkrim në të majtë të simbolit të një elementi. Për shembull, izotopi më i zakonshëm i karbonit është karboni-12, (C-12) ose si mbishkrim para (12C), i cili ka 6 protone dhe 6 neutrone. Simboli i plotë I izotopit do të kishte edhe numrin atomik (Z) si një nënshkrim në të majtë të simbolit element direkt nën numrin e masës: 126C.
Njohja e numrit të masës dhe numrit atomik të një atomi ju lejon të përcaktoni numrin e neutroneve të pranishme në atë atom.
Shembull: Atomet e elementit krom (Cr) kanë një numër atomik prej 24 dhe një numër masiv prej 52. Sa neutrone janë në bërthamën e një atomi kromi? Për të përcaktuar këtë, ju do të nënshtroni siç tregohet:
52−24=28 neutrone në një atom kromi.
Shembull tjetër: Numri i masës për Natrium (2311Na), llogaritet:
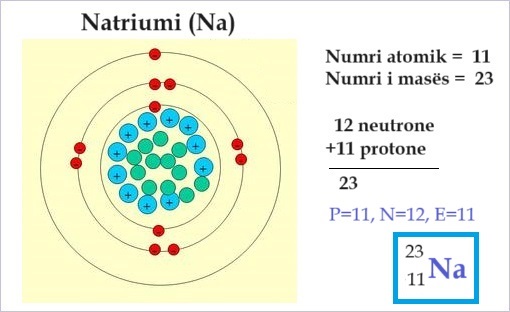
Numri i masës gjithashtu nuk duhet ngatërruar me peshën atomike standarde (e quajtur edhe pesha atomike) e një elementi, që është raporti i masës atomike mesatare të izotopeve të ndryshme të atij elementi (të peshuar nga bollëku) me konstanten e masës atomike. Pesha atomike është një raport masiv, ndërsa numri i masës është një numër i numëruar (dhe kështu një integer). (1)
Neutroni është pak më i rëndë se protoni. Kjo rrit masën e bërthamave me më shumë neutrone se protonet në raport me shkallën e njësisë së masës atomike bazuar në 12C me numër të barabartë protonesh dhe neutronesh.
Llojet e ndryshme të prishjes radioaktive karakterizohen nga ndryshimet e tyre në numrin e masës si dhe numrin atomik, sipas ligjit të zhvendosjes radioaktive të Fajans dhe Soddy. Për shembull, uraniumi-238 zakonisht prishet nga prishja alfa, ku bërthama humbë dy neutrone dhe dy protone në formën e një thërrmije alfa. Kështu numri atomik dhe numri i neutroneve secili zvogëlohet.
Çfarë është një Numër atomik dhe Numri i masës
Numri i protoneve në një atom quhet numri atomik i tij. Ky numër është i rëndësishëm sepse është unik për atomet e një elementi të caktuar. Të gjithë atomet e një elementi kanë të njëjtin numër protonesh, dhe çdo element ka një numër të ndryshëm protonesh në atomet e tij. Për shembull, të gjithë atomet e heliumit kanë dy protone dhe asnjë element tjetër nuk ka atome me dy protone. Në rastin e heliumit, numri atomik është 2. Numri atomik i një elementi zakonisht shkruhet përpara dhe pak më poshtë simbolit të elementit, si në figurën më poshtë për heliumin.

Ka një numër tjetër në kutinë e mësipërme për heliumin. Ky numër është Numri i masës ose numri masiv, i cili është masa e atomit në një njësi të quajtur njësia e masës atomike (amu). Një amu është e barabartë me 1,6 x 10-27 kg.
1 njësi e masës atomike (amu) korrespondon me 1.660539040 × 10−24 gram. Njësia e masës atomike quhet edhe dalton (Da), sipas kimistit anglez John Dalton. (2)
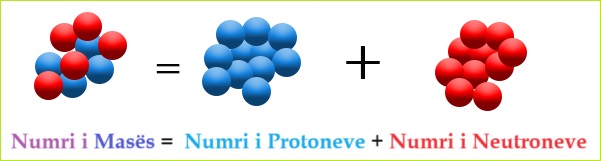
Masa e një atomi përcaktohet kryesisht nga numri i përgjithshëm i protoneve dhe neutroneve të pranishëm në bërthamë. Meqenëse masa e një elektroni është shumë e vogël në krahasim me atë të protoneve dhe neutroneve, kontributi i tij është pothuajse i papërfillshëm.
Numri masiv i një atomi = numri total i protoneve + numri total i neutroneve = numri i nukleoneve
Konsideroim përsëri Heliumin. Shumica e atomeve të heliumit kanë dy neutrone përveç dy protoneve. Prandaj, masa e shumicës së atomeve të heliumit është katër njësi të masës atomike (2 amu për protonet + 2 amu për neutronet). Megjithatë, disa atome të heliumit kanë më shumë ose më pak se dy neutrone. Atomet me të njëjtin numër protonesh por me numër të ndryshëm neutronesh quhen izotope. Për shkak se numri i neutroneve mund të ndryshojë për një element të caktuar, numri i masës së atomeve të tjera të një elementi mund të ndryshojë gjithashtu. Për shembull, disa atome të heliumit kanë tre neutrone në vend të dy. Prandaj, ata kanë një numër masiv të ndryshëm nga ai i dhënë në kutinë e mësipërme.
Pyetje: Sa është numri masiv i një atomi të heliumit me tre neutrone?
Përgjigje: Numri masiv është numri i protoneve plus neutronet. Për atomet e heliumit me tre neutrone, numri i masës është 2 (protone) + 3 (neutrone) = 5.
Prandaj:
- Numri i protoneve në një atom quhet numri atomik i tij. Kjo është gjithashtu unike për çdo element.
- Numri i masës (masiv) i një atomi është masa e tij në njësi të masës atomike (amu), e barabartë me numrin total të protoneve dhe neutroneve në atom.
- Në paraqitjen simbolike të një elementi, numri i protoneve shkruhet në pjesën e poshtme të majtë, ndërsa numri i masës shkruhet në pjesën e sipërme të majtë të simbolit kimik.
- Izotopet e ndryshëm të një elementi kanë numra të ndryshëm masiv sepse kanë numra të tjerë neutronesh.
Masa e Atomit vie nga nukleoni (berthama). Numri i përgjithshëm i protoneve dhe neutroneve në një bërthamë. Masa e elektronit është pothuajse i papërfillshëm. Kujtoim që elektroni peshon afër 1/1836 e Protonit ose Neutronit. Masa # = P+ + n0
Siç u përmend më herët, masa e një protoni është afërsisht 1,67262192 × 10^-27 kilogramë (kg). Masa e një elektroni është dukshëm më e vogël, rreth 9,10938356 × 10^-31 kg. Kjo e bën protonin afërsisht 1836 herë më masiv se elektroni. (3)
Historia e përcaktimeve të peshës atomike (Numri i masës)
Si pjesë e hulumtimit të tij mbi atomet, John Dalton përcaktoi një numër peshash atomike të elementeve në fillim të viteve 1800. Peshat atomike ishin baza për tabelën periodike që zhvilloi Mendelievi. Fillimisht të gjitha peshat atomike bazoheshin në një krahasim me hidrogjenin, i cili ka një peshë atomike prej një. Pas zbulimit të protonit, shkencëtarët supozuan se pesha e një atomi ishte në thelb ajo e protoneve— elektronet njiheshin se nuk kontribuonin pothuajse asgjë në peshën atomike të elementit.
Kjo metodë funksionoi derisa mësuam se si të përcaktonim numrin e protoneve në një element. Pastaj pamë se pesha atomike për një element ishte shpesh dyfishi i numrit të protoneve (ose më shumë). Zbulimi i neutronit siguroi pjesën e humbur të tablosë. Masa atomike tani dihet se është shuma e protoneve dhe neutroneve në bërthamë. (4).
Numri i masës e përqendruar në bërthamë
Rutherford tregoi se shumica dërrmuese e masës së një atomi është e përqendruar në bërthamën e tij, e cila është e përbërë nga protone dhe neutrone. Numri i masës përkufizohet si numri i përgjithshëm i protoneve dhe neutroneve në një atom. Mund të llogaritet duke shtuar së bashku numrin e neutroneve dhe numrin e protoneve (numri atomik).
Numri i masës = numri atomik + numri i neutroneve
Shqyrtoim:
Më poshtë që tregon të dhënat nga gjashtë elementet e para të tabelës periodike.
Tabela 1: Atomet e gjashtë elementeve të para.
| Emri | Simboli | Protonet | Neutronet | Elektronet | Numri atomik | Numri i masës |
| Hidrogjeni | H | 1 | 0 | 1 | 1 | 1 |
| Helium | He | 2 | 2 | 2 | 2 | 4 |
| Litium | Li | 3 | 4 | 3 | 3 | 7 |
| Beryllium | Be | 4 | 5 | 4 | 4 | 9 |
| Boron | B | 5 | 6 | 5 | 5 | 11 |
| Karboni | C | 6 | 6 | 6 | 6 | 12 |
–
Shqyrtoim elementin helium. Numri atomik i tij është 2, kështu që ka dy protone në bërthamën e tij. Bërthama e saj përmban edhe dy neutrone. Që nga 2plus2=4, ne e dimë se numri i masës së atomit të heliumit është 4. Së fundi, atomi i heliumit përmban edhe dy elektrone pasi numri i elektroneve duhet të barazohet me numrin e protoneve.
Ky shembull mund t’ju bëjë të besoni se atomet kanë të njëjtin numër protonesh dhe neutronesh, por shqyrtimi i mëtejshëm i tabelës më sipër do të tregojë se nuk është kështu.
Litiumi, për shembull, ka tre protone dhe katër neutrone, duke e lënë atë me një numër masiv prej 7.
Njohja e numrit të masës dhe numrit atomik të një atomi ju lejon të përcaktoni numrin e neutroneve të pranishme në atë atom.
Numri i neutroneve = numri i masës − numri atomik
Pytje: Sa neutrone janë në bërthamën e një atomi kromi? Atomet e elementit krom (Cr) Kanë një numër atomik prej 24 dhe një numër masiv prej 52.
Zgjidhja: Për të përcaktuar këtë, ju nënshtroni numrin atomik nga numri i masës, siç tregohet më sipër: 52−24=28 neutrone në një atom kromi.
Përbërja e çdo atomi mund të ilustrohet me një notacion të shkurtër duke përdorur numrin atomik dhe numrin e masës (A/Z). Të dy janë shkruar para simbolit kimik, me numrin e masës të shkruar si mbishkrim dhe numrin atomik të shkruar si nënshkrim. Atomi i kromit i diskutuar më sipër do të shkruhej si: 5224Cr.
Një mënyrë tjetër për t’iu referuar një atomi specifik është të shkruash numrin masiv të atomit sipas emrit, të ndarë nga një hajmali. Atomi i mësipërm do të shkruhej si Krom-52.
Për Kobalt (5927Co):
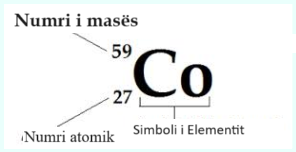
Një mënyrë tjetër për t’iu referuar një atomi specifik është të shkruash numrin masiv të atomit sipas emrit, të ndarë nga një hajmali. Atomi i mësipërm do të shkruhej si Kobalt-59.
–
Numri i masës në Tabelën Periodike të Elementeve Kimike

Numri i Masës A në Tabelën Periodike të Elementeve Kimike.
–
Shembuj:(5)
Sh1: Llogaritni secilën nga tre grimcat subatomike dhe jepni emra specifikë të grupit ose periudhës për çdo atom.
- Merkuri
- Platin
- Bromin
Zgjidhjet
- Hg (metali i tranzicionit)- ka 80 elektrone, 80 protone dhe 121 neutrone
- Pt (metali i tranzicionit)- ka 78 elektrone, 78 protone dhe 117 neutrone
- Br (halogjen)- ka 35 elektrone, 35 protone dhe 45 neutrone
Sh2: Shkruani formatet A/Z dhe simbol-masë për atomet në Shembull Sh1.
Zgjidhjet
- 20180Hg dhe Hg-201
- 19578Pt dhe Pt-195
- 8035Br3580 dhe Br-80
Sh3: Identifikoni elementet në bazë të deklaratave më poshtë.
- Cili element ka 25 protone?
- Cili element ka 0 neutrone?
- Cili element ka 83 elektrone?
Zgjidhjet
- a. Mangan
- b. Hidrogjen
- c. Bismuth
- etj.
Reference: