Karboni, element kimik, ka simbolin C, numrin atomik 6 dhe numri i masës 12. Karboni 6C12, element kimik jometalik gjendet në grupin 14 (IVa) të tabelës periodike.
Karboni është një element kimik, i emruar nga latinishtja; carbo ‘qymyr’). Karboni në formën e qymyrit (thëngjillit) është një karburant i rëndësishëm.
Karboni është një nga elementët e paktë të njohur që nga antikiteti. Karboni si element u zbulua nga personi i parë që merret me qymyr druri nga zjarri. Kështu, së bashku me squfurin, hekurin, kallajin, plumbin, bakrin, mërkurin, argjendin dhe arin, karboni ishte një nga grupet e vogla të elementeve të mirënjohura në botën e lashtë.
Karboni ka tre allotrope kryesore: grafit, diamant dhe fullerene. Allotropet e karbonit përbëhen vetëm nga atomet e karbonit. Kështu, të gjitha ato janë forma më e pastër e karbonit. Çdo atom karboni mund të formojë një maksimum prej katër lidhjesh. Si rezultat, mund të marrë disa forma.
Kimi organike, ka të bëjë me karbonin dhe përbërjet e tij. Karboni bën shumë lloje komponimesh. Hidrokarburet janë molekula me karbon dhe hidrogjen. Metani, Propani dhe shumë lëndë djegëse të tjera janë hidrokarbure. Shumë nga substancat që njerëzit përdorin çdo ditë janë komponime organike. Karboni – Fakte rreth një elementi që është një përbërës kyç për jetën në Tokë.
Në vitin 1961 izotopi karbon-12 u zgjodh për të zëvendësuar oksigjenin si standard në raport me të cilin maten peshat atomike të të gjithë elementeve të tjera. Karboni-14, i cili është radioaktiv, është izotopi i përdorur në datimin e radiokarbonit. Carbon | Facts, Uses, & Properties | Britannica1.
- Vetitë e elementit 6C12 Karboni
| Vetitë e elementit | |
| Numri atomik | 6 |
| Masa atomike | 12.0096 deri 12.0116 |
| Pika e shkrirjes | 3.550 °C (6.420 °F) |
| Pika e vlimit | 4.827 °C (8.721 °F) |
| Dendësia | v |
| Diamanti | 3.52 g/cm3 |
| Grafite | 2.25 g/cm3 |
| Amorfe | 1.9 g/cm3 |
| Gjendjet e oksidimit | +2, +3, +4 |
| Konfigurimi i elektroneve | 1s22s22p2 |
–
Komponimet e karbonit janë: monksidi i karbonit CO, dioksidi i karbonit CO2.
[Carbon – Wikipedia2: Karboni (nga latinishtja carbo ‘qymyr’) është një element kimik; Ka simbolin C dhe numrin atomik 6. Është jometallike dhe tetravalente— që do të thotë se atomet e tij janë në gjendje të formojnë deri në katër lidhje kovalente për shkak të guaskës së valencës që paraqet 4 elektrone. I përket grupit 14 të tabelës periodike. Karboni përbën rreth 0,025 për qind të kores së Tokës. Tre izotope ndodhin natyrshëm, 12C dhe 13C janë të qëndrueshme, ndërsa 14C është një radionuklid, duke u prishur me një gjysmë-jetë prej 5.700 vjetësh. Karboni është një nga elementët e paktë të njohur që nga antikiteti.
Karboni është elementi i 15-të më i bollshëm në koren e Tokës, dhe elementi i katërt më i bollshëm në univers nga masa pas hidrogjenit, heliumit dhe oksigjenit. Bollëku i karbonit, shumëllojshmëria unike e komponimeve organike dhe aftësia e pazakontë e tij për të formuar polimerë në temperaturat që hasen zakonisht në Tokë, i mundëson këtij elementi të shërbejë si një element i përbashkët i gjithë jetës së njohur. Është elementi i dytë më i bollshëm në trupin e njeriut nga masa (rreth 18.5%) pas oksigjenit.
Atomet e karbonit mund të lidhen së bashku në mënyra të ndryshme, duke rezultuar në allotrope të ndryshme të karbonit3. Allotropet e njohura përfshijnë grafitin, diamantin, karbonin amorf dhe fullerenes. Vetitë fizike të karbonit ndryshojnë gjerësisht me formën allotropike. Për shembull, grafiti është opak dhe i zi, ndërsa diamanti është shumë transparent. Grafiti është mjaft i butë për të formuar një seri në letër (prandaj emri i tij, nga folja greke “γράφειν” që do të thotë “të shkruash”), ndërsa diamanti është materiali më i vështirë që ndodh natyrshëm i njohur. Grafiti është një përçues i mirë elektrik ndërsa diamanti ka një përçueshmëri elektrike të ulët. Në kushte normale, diamanti, nanotubet e karbonit dhe grafeni kanë përçueshmërinë termike më të lartë të të gjitha materialeve të njohura. Të gjitha allotropet e karbonit janë të ngurta në kushte normale, me grafitin që është forma më termodinamike e qëndrueshme në temperaturën dhe presionin standard. Ato janë rezistente kimikisht dhe kërkojnë temperaturë të lartë për të reaguar edhe me oksigjen.
Gjendja më e zakonshme e oksidimit të karbonit në komponimet inorganike është +4, ndërsa +2 gjendet në monoksidin e karbonit dhe komplekset e karbonit metalik të tranzicionit. Burimet më të mëdha të karbonit inorganik janë gurët gëlqerorë, dolomitët dhe dioksidi i karbonit, por sasi të konsiderueshme ndodhin në depozitat organike të qymyrit, bizeles, naftës dhe klathrateve të metanit. Karboni formon një numër të madh komponimesh, me rreth dyqind milionë që janë përshkruar dhe indeksuar; Dhe megjithatë ky numër nuk është veçse një fraksion i numrit të komponimeve teorikisht të mundshme në kushte standarde.]
Përdorimet4
Karboni është një përbërës jetësor i të gjitha sistemeve të gjalla të njohura dhe pa të jeta që ne njohim nuk do të ekzistonte. Përdorimi kryesor komercial i karbonit është në formë hidrokarburesh, kryesisht lëndë djegëse, gas metan dhe naftë. Nafta përdoret nga industria për të prodhuar mes të tjerash dhe benzinën nëpër rafineri nëpermjet një procesi distilues. Nafta është burim gjithashtu i materialit bazë per shume substanca sintetike me emrin plastikë.
Përdorime te tjera :
- Izotopi 14C i zbuluar më 27 shkurt 1940, përdoret për të gjetur moshën e radiokarbonit.
- Grafiti përdoret për lapsat e vizatimit.
- Diamantet përdoren për qëllime zbukurimi por edhe si maja shpuese në veprimtari që shfrytezojnë fortësinë e tyre.
- Një përqindje karboni i shtohet hekurit per te prodhuar çelikun. Po me hekurin por në një perqindje më të lartë prodhohet giza e cila është mjaft rezistente.
- Karboni përdoret nëpër centrale bërthamore.
- Një formë e karbonit mund të përdoret për ngrohje.
- Përdoret si fibër përforcuese në shkopat e hokeit dhe në veshjet e jashtme e të brendshme të makinave sportive dhe atyre të garave si për rezistencën por edhe për lehtësinë e tij GJINDET I LIRE DHE I LIDHUR. I lit gjidet si diamanti, grafiti, fulloreni dhe bloza.i lidhur formon komponime organike mbi 15 milion, dhe joorganike CO, CO2 dhe disa karbonete.DIAMANTI eshte forme e karbonit i cili ne natyre krijohet me nje sasi te vogel ne thellesira tokesore. Eshtesubstance e ngurte ne forme te kristaleve ku kristalet kane ngjyra te tejdukshme, te bardhe, te gjelber tkalter, tekuqe e te zeze.kristalet e diamanteve shkelqejne shume dhe nga shkelqimi i madh qe kan e thejne driten. numerohet nje nder substancat me te forta dhe diamnati thehet vetem me diamant.perdoret poer stolisje, per industri per prodhimin e veglave te ndryshme qe perdoren per shpuarjen e shkembinjve dhe per prerjen e qelqit dhe qeramikes se ndryshme.GRAFITI-eshte forme e dyte e karbonit i cili dallohet prej diamantit sepse edhe ky eshte i ngurte por jo i forte sa diamanti, ne forme te kristaleve me ngjyre te murrme,nuk shkelqejne dhe nuk e thejne driten. Perdoret ne industri per prodhimin e lapsave te shkrimit.QYMYRI-eshte forme e karbonit te cilen e krijon natyra ne thatesira tokesore,substance e ngurte me ngjyre te zeze perdoret ne industri per prodhimin e energjise se rr.e dhe ne ekonomi shtepiake si lende djegese.BLOZA-eshte forme e fundit e karbonit ne forme te pluhurit me ngjyre te zeze dhe perdoret ne industri per prodhimin e ngjyres se zeze.
Histori
Karboni (nga latinishtja “carbo”) u zbulua në parahistori dhe u njoh nga popullsitë antike që e prodhonin duke djegur materiale organike me pak oksigjen. Diamantët për shumë kohë janë konsideruar të rrallë e të mahnitshem. Ndërsa alotropi i fundit, fulereni, u zbulua si nënprodukt i eksperimenteve me rreze molekulare ne vitet ’80.
Katër alotropet e karbonit jane: karboni ammorf, diamanti, grafiti dhe fulereni.
- Karboni amorf, në formen e tij amorfe karboni është kryesiht grafit por nuk ruan strukturen kristalore. Është i pranishem si pluhur që formon përbërësit kryesor të substancave si karboni dhe bloza.
- Grafiti, në trysni normale karboni merr formë grafiti, tek i cili çdo atom lidhet me tre te tjerë në një plan te përberë nga unaza gjashtekendore te shkrira me njera tjetren, si ne hidrokarburet aromatike. Dy format e njohura te grafitit, alfa (hekzagonal) dhe beta (romboidal) kane te njejtat veti fizike perveç struktures kristalore. Grafiti qe gjendet ne natyre permban deri ne 30 % te formes beta, ndersa ai i prodhuar ne laborator eshte i gjithi alfa. Forma alfa mund te kthehet ne beta nepermjet nje trajtimi mekanik dhe forma beta rikthehet ne alfa kur nxehet mbi 1000 °C.
Për shkak te çlokalizimit të rese PI, grafiti e percjell elektricitetin. Materiali është i bute dhe fletat të cilat ndahen shpesh nga atome të tjera, qëndrojnë së bashku falë forcave të Van der Valsit dhe mund të rrëshqasin lehtësisht mbi njëra tjetrën.
Grafeni është një alotrop i karbonit i përbërë nga një shtresë e vetme atomesh të rregulluar në një nanostrukturë grilë gjashtëkëndore. Çdo atom në një fletë grafeni është i lidhur me tre fqinjët e tij më të afërt. Emri rrjedh nga “grafit” dhe prapashtesa –ene, duke pasqyruar faktin se alotropi grafit i karbonit përmban lidhje të shumta të dyfishta.
- Diamanti, në trysni shume të larte karboni formon diamantin, ku një atom është i lidhur me ketër të tjerë. Diamantet kanë të njëjtën strukturë kubike si silici dhe germaniumi dhe falë forcës së lidhjes kimike karbon-karbon është së bashku me nitrurin e borit substanca më e fortë përsa i përket rezistencës. Tranzicioni i grafitit në temperaturë ambienti është aq i ngadalshëm sa nuk vihet re. Në kushte të caktuara, karboni, kristalizohet si Lonsdaleit, një formë e njgjajshme me diamantin por me strukturë hekzagonale.
- Fulereni (Karboni i bardhë), Është formë e re e karbonit e zbuluar në tokë në sasi të vogla, ndërsa është zbuluar se gjendet edhe në gjithësi (kozmos) dhe në disa meteore. Në mënyrë sintetike në laborator është përfituar për herë të parë në vitin 1990. Përbëhet nga molekulat sferike që përmbajnë më shumë se 40 atome të karbonit. Fulereni e ka marrë emrin sipas arkitektit të njohur amerikan Buckminister Fuller, i cili e ka koonstruktuar kupolën gjedoete. Konsiderohet që fulereni stabil është C60 ose bakministerfulereni, i cili përbëhet nga 12 unaza pesëkëndëshe dhe 20 unaza gjashtëkëndëshe.
Bollëku
Ekzistojnë pothuajse 10 milion përberje te njohura karboni, dhe mijëra prej tyre janë thelbësore në proceset jetësore dhe të rëndësishme për reaksionet organike. Karboni gjendet me bollëk tek Dielli, yjet, kometat dhe në atmosferën e pjesës më të madhe të planeteve. Disa meteorite përmbajnë diamante mikroskopike që u formuan kur sistemi diellor ishte ende një disk protoplanetar. I kombinuar me elemente të tjera, karboni gjendet në atmosferën tokësore dhe në gjithë botën ujore. Bashkuar me disa sasi të vogla kalciumi, magnezi dhe hekuri, është një nga përbërësit kryesorë të karboantit, shkëmbinëjve dhe mermerit. I kombinuar me hidrogjenin formon naftë, gaz natyror dhe hidrokarbure te tjera.
Grafiti ndodhet ne sasi te medha ne SHBA, Rusi, Meksike, Grenlandë dhe Indi. Pjesa më e madhe e diamanteve ndodhet ne Afrikë sidomos ne Afrikën e Jugut, Namibi, Botsvana, Republiken e Kongos dhe Sierra Leone. Por gjithashtu sasi të mëdha diamantesh ndodhen edhe ne Kanada, Rusi dhe Australi.
Komponimet inorganike të karbonit
Oksisdi kryesor i karbonit është dioksidi i karbonit, CO2. Ai është një përbërës i paktë i atmosferës tokësore i cili përdoret dhe prodhohet nga krijesat e gjalla. Në ujë formon gjurmë acidi karbonik H2CO3, por si shumë përbërje me shume atome oksigjeni te lidhur me një karbon te vetem, është i paqëndryeshëm. Okside të tjera janë monoksidi i karbonit CO dhe ai më pak i zakonshem C3O2. Monoksidi formohet nga një djegje e pjesshme dhe është një gaz pa erë e pa ngjyrë. Çdo molekulë përmban një lidhje dyfishe dhe shfaqet e polarizuar dhe tenton të lidhet me molekulën hemoglobines, gjë që e bën këtë gaz helmues. Cianuri, CN-, ka strukturë dhe sjellje të ngjajshme me halogjenuret.
Komponimet organike të karbonit
Quhen “organike” ato përberje të karbonit ku ky ka numer oksidimi me te vogel se +4. Një veçori e karbonit eshte aftësia për të formuar zinxhire atomike me gjatësi të ndryshme, edhe ciklike. Këto zinxhire janë baza e hodrokarbureve dhe përberjeve organike.
Cikli i karbonit
Është procesi i vazhdueshem i kombinimit dhe çlirimit të karbonit dhe oksigjenit të qenieve të gjalla që magazinon dhe çliron nxehtësi dhe energji. Cikli i karbonit ndodh kryesisht në katër rezerva: e para është biosfera, e dyta hidrosfera, e treta litosfera dhe e fundit atmosfera.
Izotopet
Para vitit 1959, si IUPAP5 ashtu edhe IUPAC6 përdornin oksigjen7 për të përcaktuar mole8; Kimistët e përcaktojnë mole si numrin e atomeve të oksigjenit që kishin masë 16 g, fizikanët përdorën një përkufizim të ngjashëm, por vetëm me izotopin oksigjen-169. Të dy organizatat ranë dakord në 1959-60 për të përcaktuar mole si më poshtë.
Mole është sasia e substancës së një sistemi që përmban aq shumë entitete elementare sa ka atome në 12 gram karbon 12; simboli i tij është “mol”.
Në vitin 1961, izotopi karboni-12 u zgjodh për të zëvendësuar oksigjenin si standard në lidhje me të cilin maten peshat atomike të të gjithë elementëve të tjerë.
Në vitin 2018, IUPAC specifikoi mole si saktësisht 6.02214076×1023 “entitete elementare”. Numri i moleve në 12 gram karbon-12 u bë çështje përcaktimi eksperimental.
Karboni-14 është një radioizotop që përdoret për datimin e drurit dhe vendeve arkeologjike.
Dëmet
Përberjet e karbonit kanë edhe veprime toksike. Monoksidi i karbonit i cili gjendet në gazrat që shkarkojnë motorrat me diegje, cianuri i cili ndonjëherë ndot minierat, janë shumë të dëmshëm për gjitarët.
–
VLERAT TABELARE PËR KARBON (nga: Carbon – Wikipedia)
| Karboni: 6C |
| Alotropet: grafiti, diamanti dhe më shumë (shih Alotropet e karbonit) |
| Pamja:Grafiti: i zi, me pamje metalike, diamant: i pastër, i tejdukshëm. |
| Pesha standarde atomike Ar° (C): [12.0096, 12.0116], 12.011±0.002 (shkurtuar) |
| Karboni në tabelën periodike |
| Numri atomik (Z): 6 |
| Grupi: 14 (grupi i karbonit) |
| Periudha: 2 |
| Bllok: p |
| Konfigurimi i elektroneve: 1s2 2s2 2p2 |
| Elektronet për guaskë: 2, 4 |
| Vetitë fizike |
| Faza në Standart Temperatur Presion (STP): i ngurtë |
| Pika e sublimimit: 3915 K (3642 °C, 6588 °F) |
| Dendësia (afër 20°C) Grafiti: 2.266 g/cm3, Diamant: 3.515 g/cm3, amorf: 1.8–2.1 g/cm3 |
| Pikë e trefishtë: 4600 K, 10,800 kPa |
| Nxehtësia e shkrirjes: grafiti: 117 kJ/mol |
| Kapaciteti molar i nxehtësisë: grafiti: 8.517 J/(mol· K), diamant: 6.155 J/(mol· K) |
| Vetitë atomike |
| Gjendjet e oksidimit e zakonshme: −4, −3, −2, −1, 0, +1, +2, +3, +4 |
| Elektronegativiteti Shkalla Pauling: 2.55 |
| Energjitë e jonizimit: • 1: 1086.5 kJ/mol, • 2: 2352.6 kJ/mol, • 3: 4620.5 kJ/mol, • (më shumë) |
| Rrezja kovalente: sp3: 77 pm (pikometër), sp2: 73 pikometër, sp: 69 pikometër. |
| Rrezja e Van der Waals: 170 pm (pikometër). |
| Linjat spektrale të karbonit — |
| Veti të tjera |
| Dukuria natyrore: parësore |
Struktura kristalore: 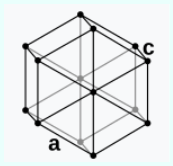 grafit: gjashtëkëndor i thjeshtë (hP4): Konstantet e grilës: a = 246.14 pm, c = 670.94 pm (në 20 °C). grafit: gjashtëkëndor i thjeshtë (hP4): Konstantet e grilës: a = 246.14 pm, c = 670.94 pm (në 20 °C). |
Struktura kristalore: 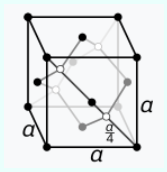 diamant: diamant-kub me në qendër fytyrën (cF8): Konstanta e grilës: a = 356.707 pm, (në 20 °C). diamant: diamant-kub me në qendër fytyrën (cF8): Konstanta e grilës: a = 356.707 pm, (në 20 °C). |
| Zgjerimi termik diamant: 0.8 μm/(m⋅K) (në 25 °C) |
| Përçueshmëria termike: grafiti: 119–165 W/(m⋅K), diamant: 900–2300 W/(m⋅K) |
| Rezistenca elektrike grafiti: 7.837 μΩ⋅m |
| Renditja magnetike: diamagnetike |
| Ndjeshmëria magnetike molare diamant: −5.9×10−6 cm3/mol |
| Moduli i Young: diamant: 1050 GPa |
| Moduli i prerjes diamant: 478 GPa |
| Moduli i shumicës diamant: 442 GPa |
| Shpejtësia zërit e shufrës së hollë të diamantit: 18,350 m/s (në 20 °C) |
| Raporti i efektit Poisson, deformimi (zgjerimi ose tkurrja): diamant: 0.1 |
| Fortësia e Mohs: Grafiti: 1–2, Diamanti: 10 |
| Numri CAS: • Karboni atomik: 7440-44-0, • grafiti: 7782-42-5, • diamant: 7782-40-3 |
| Histori |
| Emërtimi: nga latinishtja carbo për qymyr dhe qymyr druri |
| Zbulimi: Egjiptianët dhe sumerët: (3750 pes) |
| Njihet si element nga Antoine Lavoisier: (1789) |
| Izotopet e karbonit: 11C: bollëk: sintezë, gjysmë jetë (t1/2): 20.34 minuta, modaliteti β+, produrti: 11B (Bori). 12C: bollëk: 98.9%, gjysmë jetë i qëndrueshëm. 13C: bollëk: 1.06%, gjysmë jetë i qëndrueshëm. 14C: 1 ppt (1⁄1012), gjysmë jetë (t1/2): 5.70×103y dhe modaliteti: β− , produkti: 14N (Azoti). |
–
Referenca
- Carbon | Facts, Uses, & Properties | Britannica ↩︎
- Carbon – Wikipedia ↩︎
- Allotropes of carbon – Wikipedia ↩︎
- Karboni – Wikipedia ↩︎
- International Union of Pure and Applied Physics – Wikipedia ↩︎
- International Union of Pure and Applied Chemistry – Wikipedia ↩︎
- Oxygen – Wikipedia ↩︎
- Mole (unit) – Wikipedia ↩︎
- Oxygen-16 – Wikipedia ↩︎



