Fosfori, ka simbolin P dhe numrin atomik 15. Është element kimik jometalik i familjes së azotit (Grupi 15 [Va] i tabelës periodike) që në temperaturën e dhomës është një lëndë e ngurtë pa ngjyrë, gjysmëtransparente, e butë, dylli që shkëlqen në errësirë. Fosfori është shumë reaktiv dhe nuk gjendet kurrë si një element i lirë në Tokë. Ka një përqendrim në koren e Tokës prej rreth një gram për kilogram. Në minerale, fosfori zakonisht paraqitet si fosfat.
- Fosfori në dietën tuaj.
- Fosfori dhe shëndeti.
- Fosfori: komponimet, reaksionet kimike dhe aplikimet.
- Fosfori në përdorim.
Përdorimet
Fosfori i prodhuar konsumohen si plehra. Fosfati nevojitet për të zëvendësuar fosforin që bimët e largojnë nga toka dhe kërkesa e saj vjetore po rritet gati dy herë më shpejt se rritja e popullsisë njerëzore. Aplikacione të tjera përfshijnë komponimet organofosfor në detergjentë, pesticide dhe agjentë nervorë.
Zbatimet piroteknike të elementit përfshijnë gjurmues, ndezës, fishekzjarrë dhe shkrepëse. Një pjesë përdoret si agjent aliazh, një pjesë përdoret për të vrarë brejtësit dhe pjesa tjetër përdoret në sintezën kimike. Një sasi e madhe shndërrohet në sulfide të përdorura në shkrepëse dhe në prodhimin e insekticideve dhe aditivëve të vajit. Pjesa më e madhe e pjesës së mbetur shndërrohet në halide ose okside për përdorim të mëvonshëm në sintezën e komponimeve organike të fosforit.
Pse na duhet fosfori?
Fosfori është jetik në formimin e kockave dhe dhëmbëve dhe është thelbësor për të ndihmuar trupin të përdorë dhe ruajë energjinë. Ai gjithashtu ndihmon në rregullimin e funksionit të veshkave dhe nervave, tkurrjeve të muskujve dhe rrahjeve të zemrës dhe është jetik për funksionimin normal të çdo qelize në trupin tonë.(1)
Vetitë e Fosforit – nga Wikipedia2
| Fosfori: simboli P, perioda 3, bllok p, grupi 15 (Va, ose grupi i azotit) |
| Numri atomik: 15 |
| Pesha atomike: 30.974 |
| Pika e shkrirjes: i bardhë: 317.3 K (44.15 °C, 111.5 °F), i kuq: ∼860 K (∼590 °C, ∼1090 °F) |
| Pika e vlimit: i bardhë: 553.7 K (280.5 °C, 536.9 °F) |
| Pika e sublimimit: kuq: ≈689.2–863 K (≈416–590 °C, ≈780.8–1094 °F), violet: 893 K (620 °C, 1148 °F) |
| Dendësia: i bardhë: 1.823 g/cm3, i kuq: ≈2.2–2.34 g/cm3, violet: 2.36 g/cm3, i zi: 2.69 g/cm3 |
| Nxehtësia e shkrirjes: i bardhë: 0.66 kJ/mol |
| Nxehtësia e avullimit: i bardhë: 51.9 kJ/mol |
| Kapaciteti molar i nxehtësisë: 23.824 J/(mol·K) (i bardhë) |
| Kapaciteti specifik i nxehtësisë: 769.161 J/(kg·K) (i bardhë) |
| Vetitë kimike |
| Gjendjet e oksidimit të zakonshme: zakonishtë: −3, +3, +5, −2, −1, 0, +1, +2, +4 |
| Shkalla e elektronegativitetit Pauling: 2.19 |
| Histori |
| Emërtimi: nga greqishtja Phosforos, që do të thotë ‘bartës i dritës’ |
| Zbulimi: Marka Hennig (1669) |
| Njihet si element nga Antoine Lavoisier |
| – |
Në 1680, Boyle gjithashtu arriti të prodhonte fosfor dhe botoi metodën e prodhimit të tij. [14] Ai ishte i pari që përdori fosforin për të ndezur splintat e drurit me majë squfuri, pararendëse të ndeshjeve moderne,[18] dhe gjithashtu përmirësoi procesin duke përdorur rërë në reagim:
4 NaPO3 + 2 SiO2 + 10 C → 2 Na2SiO3 + 10 CO + P4
Ndihmësi i Boyle, Ambrose Godfrey-Hanckwitz më vonë bëri një biznes të prodhimit të fosforit.
Në 1777, Antoine Lavoisier e njohu fosforin si një element pasi Johan Gottlieb Gahn dhe Carl Wilhelm Scheele treguan në 1769 se fosfati i kalciumit gjendet në kocka duke marrë fosforin elementar nga hiri i kockave. Hiri i kockave më pas u bë burimi kryesor industrial i fosforit dhe mbeti i tillë deri në vitet 1840. Procesi përbëhej nga disa hapa. Së pari, bluarja e kockave në fosfat trikalcium përbërës dhe trajtimi i tij me acid sulfurik:
Ca3(PO4)2 + 2 H2SO4 → Ca(H2PO4)2 + 2 CaSO4
Pastaj, dehidratimi i fosfatit monokalcium që rezulton:
Ca(H2PO4)2 → Ca(PO3)2 + 2 H2O
Së fundi, përzierja e metafosfatit të kalciumit të marrë me qymyrin e bluar ose qymyr druri në një tenxhere hekuri dhe distilimi i avujve të fosforit nga një retortë:
3 Ca(PO3)2 + 10 C → Ca3(PO4)2 + 10 CO + P4
Në këtë mënyrë, dy të tretat e fosforit u shndërrua në fosfor të bardhë ndërsa një e treta mbeti në mbetje si ortofosfat kalciumi. Monoksidi i karbonit i prodhuar gjatë procesit të reaksionit u dogj në një pirg ndezjeje. – (reaksionet nga Wikipedia)3.
–
Historia e Fosforit (4)
Alkimistët arabë të shekullit të 12-të mund të kenë izoluar fosforin elementar rastësisht, por të dhënat janë të paqarta. Fosfori duket se është zbuluar në vitin 1669 nga Hennig Brand, një tregtar gjerman, hobi i të cilit ishte alkimia. Brand lejoi 50 kova me urinë të qëndronin derisa të kalbenin dhe “krimbonin”. Pastaj ai e zieu urinën deri në një pastë dhe e ngrohu me rërë, duke distiluar kështu fosforin elementar nga përzierja. Brand raportoi zbulimin e tij në një letër drejtuar Gottfried Wilhelm Leibniz, dhe, më pas, demonstrimet e këtij elementi dhe aftësia e tij për të shkëlqyer në errësirë, ose “fosforeshuar”, ngacmuan interesin publik. Fosfori, megjithatë, mbeti një kuriozitet kimik deri rreth një shekull më vonë, kur u vërtetua se ishte një përbërës i kockave. Tretja e kockave me acid nitrik ose sulfurik formoi acid fosforik, nga i cili fosfori mund të distilohej duke u ngrohur me qymyr druri. Në fund të viteve 1800, James Burgess Readman i Edinburgut zhvilloi një metodë furre elektrike për prodhimin e elementit nga shkëmbi fosfat, e cila është në thelb metoda e përdorur sot.
Ndodhja dhe shpërndarja
Fosfori është një element shumë i shpërndarë gjerësisht – i 12-ti më i bollshëm në koren e Tokës, në të cilin kontribuon rreth 0.10 përqind të peshës. Bollëku i tij kozmik është rreth një atom për 100 atome silici, standardi. Reaktiviteti i tij i lartë kimik siguron që ai nuk ndodh në gjendje të lirë (përveç në disa meteoritë). Fosfori gjithmonë ndodh si joni fosfat. Format kryesore të kombinuara në natyrë janë kripërat e fosfatit. Janë gjetur rreth 550 minerale të ndryshme që përmbajnë fosfor, por, nga këto, burimi kryesor i fosforit është seria e apatitit në të cilën ekzistojnë jonet e kalciumit së bashku me jonet e fosfatit dhe sasi të ndryshueshme të joneve të fluorit, klorurit ose hidroksidit, sipas formulës [Ca10(PO4)6(F, Cl ose OH)2]. Minerale të tjera të rëndësishme që përmbajnë fosfor janë valëliti dhe vivianiti. Zakonisht, atomet e metaleve të tilla si magnezi, mangani, stronciumi dhe plumbi zëvendësojnë kalciumin në mineral, dhe silikati, sulfati, vanadati dhe anionet e ngjashme zëvendësojnë jonet e fosfatit. Depozita shumë të mëdha sedimentare të fluoroapatitit gjenden në shumë pjesë të Tokës. Fosfati i kockave dhe smaltit të dhëmbëve është hidroksiapatiti. (Parimi i zvogëlimit të prishjes së dhëmbëve me anë të fluorizimit varet nga shndërrimi i hidroksiapatitit në fluoroapatitin më të fortë dhe më rezistent ndaj prishjes.)
Burimi kryesor komercial është fosforiti, ose shkëmbi fosfat, një formë masive e papastër e apatitit që përmban karbonat. Vlerësimet e shkëmbit total të fosfatit në koren e Tokës mesatarisht janë rreth 65,000,000,000 ton, nga të cilat Maroku dhe Sahara Perëndimore përmbajnë rreth 80 përqind. Ky vlerësim përfshin vetëm xeherorin që është mjaftueshëm i pasur me fosfat për t’u shndërruar në produkte të dobishme me metodat aktuale. Ekzistojnë gjithashtu sasi të mëdha materiali me përmbajtje më të ulët fosfori.
Prodhimi dhe përdorimet komerciale
Teknika kryesore për shndërrimin e shkëmbit fosfat në materiale të përdorshme përfshin acidifikimin e shkëmbit të grimcuar – me acide sulfurike ose fosforike – për të formuar fosfate të papërpunuara të hidrogjenit të kalciumit që, duke qenë të tretshëm në ujë, janë shtesa të vlefshme në pleh. Pjesa më e madhe e prodhimit digjet në anhidrid fosforik dhe më pas trajtohet me ujë për të formuar acid fosforik, H3PO4. Rreth 95 përqind e shkëmbit fosfat të nxjerrë në Shtetet e Bashkuara përdoret për të bërë plehra ose shtesa ushqimore për kafshët. Megjithatë, kanë lindur shqetësime në lidhje me përdorimin e fosforit. Pjesa më e madhe e fosforit shpërdorohet gjatë udhëtimit të tij nga minierat në ngrënie nga njerëzit, dhe fosfori i shpërdoruar përfundon në rrugët ujore ku mund të shkaktojë lulëzim të algave. Një shqetësim tjetër është se përdorimi i shtuar i fosforit do të pakësojë furnizimin e parinovueshëm të shkëmbit fosfat.
Cikli i fosforit
Fosfori, i cili qarkullon kryesisht nëpër mjediset tokësore dhe ujore, është një nga elementët më të rëndësishëm që ndikojnë në rritjen e bimëve.
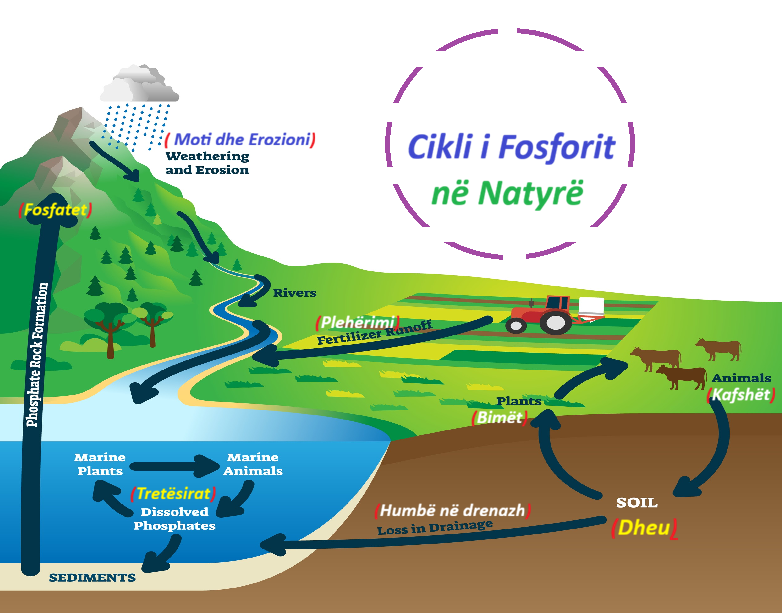
Cikli i Fosforit në Natyr – imazh2.
[Fosfori ciklohet nëpër rezervuarë të ndryshëm mjedisorë, duke përfshirë shkëmbinjtë, tokën, ujin dhe organizmat e gjallë. Cikli i fosforit përfshin procese të tilla si moti i shkëmbinjve, marrja nga bimët, konsumimi nga kafshët dhe kthimi eventual në tokë përmes dekompozimit. Ky cikël i fosforit është thelbësor për ruajtjen e ekuilibrit të kësaj lënde ushqyese thelbësore në ekosisteme dhe sigurimin e disponueshmërisë së tij për ruajtjen e jetës.]5
–
Referencat



