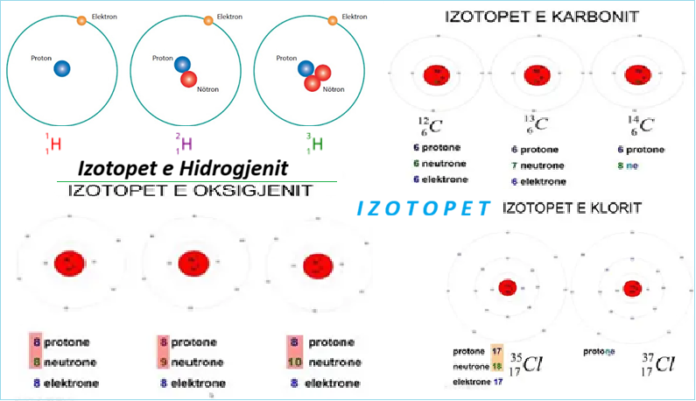
Izotopet janë atome të një elementi kimik, bërthama e të cilit ka të njëjtin numër atomik, Z, por një masë atomike ose numri i masës, të ndryshme, A. Fjala izotop do të thotë në të njëjtin vend dhe vjen nga fakti se izotopet janë të vendosura në të njëjtin vend në tabelën periodike. Një raport izotopik është një raport konstant i izotopeve në elementët kimikë në natyrë dhe një madhësi karakteristike për secilën specie atomike.
[: Izotopet janë lloje të veçanta bërthamore (ose nuklide) të të njëjtit element kimik. Ata kanë të njëjtin numër atomik (numri i protoneve në bërthamat e tyre) dhe pozicion në tabelën periodike (dhe për këtë arsye i përkasin të njëjtit element kimik), por numra të ndryshëm nukleonesh (numra mase) për shkak të numrit të ndryshëm të neutroneve në bërthamat e tyre. Ndërsa të gjitha izotopet e një elementi të caktuar kanë pothuajse të njëjtat veti kimike, ato kanë masa atomike dhe veti fizike të ndryshme.]1
Numri atomik korrespondon me numrin e protoneve në një atom, Prandaj, izotopet e një elementi të caktuar përmbajnë të njëjtin numër protonesh. Dallimi në masat atomike vjen nga ndryshimi në numrin e neutroneve në bërthamën atomike. Në nomenklaturën shkencore, izotopet shënohen me emrin e një elementi të caktuar të ndjekur nga një vizë, e ndjekur nga numri i nukleoneve (protonet dhe neutronet) në bërthamën atomike (p.sh., helium-3, karbon-12, karbon-14, hekur-57, uranium-238). Në formë simbolike, numri i nukleoneve shprehet mbi simbolin kimik në të majtë (p.sh., 3 He, 12 C, 14 C, 57 Fe, 238 U).
Termi izotop vjen nga rrënjët greke isos (ἴσος “i barabartë”) dhe topos (τόπος “vend”), që do të thotë “i njëjti vend”: izotope të ndryshme të një elementi zënë të njëjtin vend në tabelën periodike. Ajo u krijua nga mjekja dhe shkrimtarja skoceze Margaret Todd në një sugjerim të vitit 1913 për kimistin britanik Frederick Soddy, i cili e popullarizoi termin.
–
Referencat