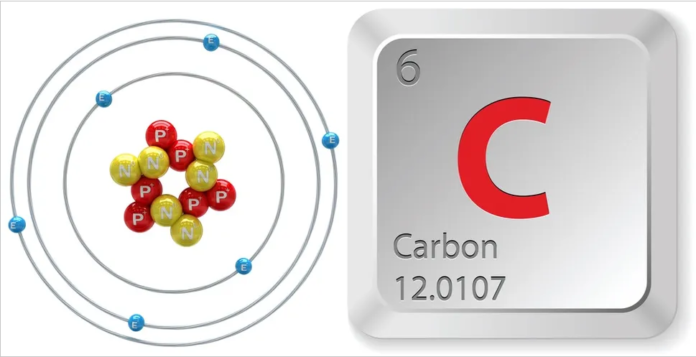
Imazhi> Struktura e neuroneve, protoneve dhe elektroneve të karbonit. (Kredia e imazhit: Shutterstock)
Nga: Livescience> Carbon: Facts about an element that is a key ingredient for life on Earth | Live Science (1)
Karboni është një element i pabesueshëm. Organizoni atomet e karbonit në një mënyrë dhe ato bëhen grafite të buta e të përkulshme. Rigjykoni rregullimin, dhe — presto! — atomet formojnë diamantin, një nga materialet më të vështira në botë.
Karboni është gjithashtu përbërësi kryesor për shumicën e jetës në Tokë; pigmenti që bëri tatuazhet e para; dhe bazën për mrekullitë teknologjike si grafeni, i cili është një material më i fortë se çeliku dhe më fleksibël se gome. [Shih Tabelën Periodike të Elementeve].
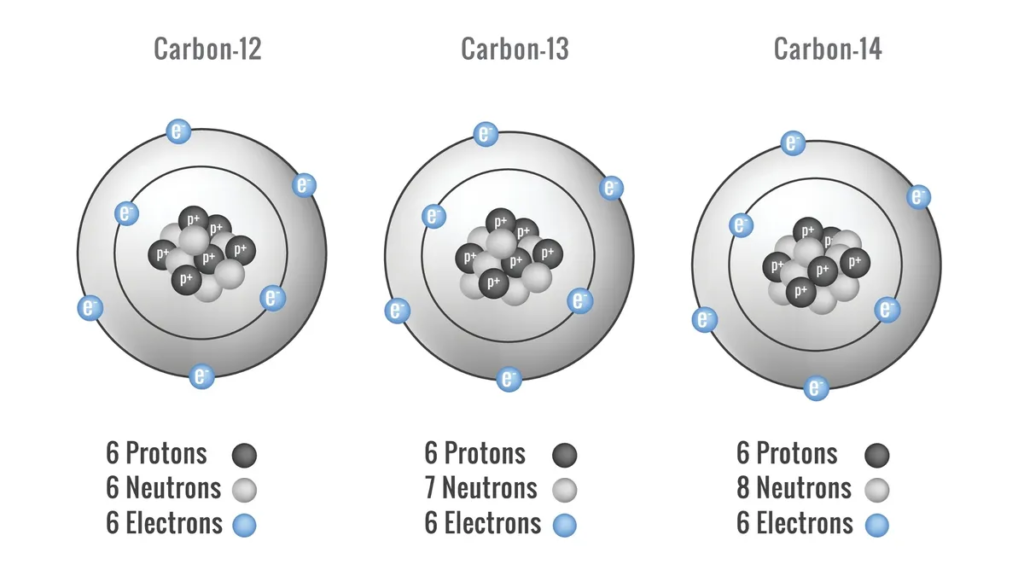
Karboni ndodh natyrshëm si karboni-12, i cili përbën pothuajse 99% të karbonit në univers; karboni-13, që përbën rreth 1%; dhe karboni-14, i cili përbën një sasi minuscule të karbonit të përgjithshëm, por është shumë i rëndësishëm në datimin e objekteve organike.
Karboni: Fakte të shpejta
- Numri atomik (numri i protoneve në bërthamë): 6
- Simboli atomik (në tabelën periodike të elementeve): C
- Pesha atomike (masa mesatare e atomit): 12.0107
- Dendësia: 2.2670 gram për centimetër kub
- Faza në temperaturën e dhomës: e ngurtë
- Pika e shkrirjes: 6.422 gradë Fahrenheit (3.550 gradë Celsius)
- Pika e vlimit: 6.872 F (3.800 C) (sublimim)
- Numri i izotopeve: 15 gjithsej; Dy izotope të qëndrueshme, të cilat janë atome të të njëjtit element me një numër të ndryshëm neutronesh.
- Izotopet më të zakonshme: karboni-12 (6 protone, 6 neutrone dhe 6 elektrone) dhe karboni-13 (6 protone, 7 neutrone dhe 6 elektrone)
–
Si formohet karboni: Nga yjet në jetë
Si elementi i gjashtë më i bollshëm në univers, karboni formohet në barkun e yjeve në një reaksion të quajtur procesi triple-alfa, sipas Swinburne Center for Astrophysics and Supercomputing.
Në yjet e vjetër që kanë djegur pjesën më të madhe të hidrogjenit të tyre, helium mbetur akumulohet. Çdo bërthamë helium ka dy protone dhe dy neutrone. Nën temperatura shumë të nxehta — më të mëdha se 100.000.000 Kelvin (179.999.540.6 F) — bërthamat e heliumit fillojnë të shkrihen, së pari si çifte në bërthama beryllium 4-proton të paqëndrueshme, dhe përfundimisht, si bërthama e mjaftueshme beryllium blink në ekzistencë, në një beryllium plus një helium. Rezultati përfundimtar: Atomet me gjashtë protone dhe gjashtë neutrone — karboni.
Karboni është një modelues. Ajo mund të lidhet me veten, duke formuar zinxhirë të gjatë dhe resilientë të quajtur polimerë. Ajo gjithashtu mund të lidhet me deri në katër atome të tjera për shkak të rregullimit të saj elektron. Atomet janë të rregulluara si një bërthamë e rrethuar nga një re elektronesh, me elektrone që zingëllojnë rreth e rrotull në distanca të ndryshme nga bërthama. Kimistët i konceptojnë këto distanca si guaska, dhe përcaktojnë vetitë e atomeve me atë që është në çdo guaskë, sipas Universitetit të Kalifornisë, Davis. Karboni ka dy guaska elektronesh, me të parin që mban dy elektrone dhe të dytin që mban katër nga tetë hapësirat e mundshme. Kur atomet lidhen, ata ndajnë elektronet në guaskën e tyre më të jashtme. Karboni ka katër hapësira boshe në guaskën e tij të jashtme, duke bërë të mundur lidhjen me katër atome të tjera. (Ajo gjithashtu mund të lidhet dukshëm me më pak atome duke formuar lidhje të dyfishta dhe të trefishta.)
Me fjalë të tjera, karboni ka mundësi. Dhe i përdor ato: Gati 10 milionë komponime karboni janë zbuluar dhe shkencëtarët vlerësojnë se karboni është guri kyç për 95% të komponimeve të njohura, sipas faqes së internetit Chemistry Explained. Aftësia e pabesueshme e karbonit për t’u lidhur me shumë elementë të tjerë është një arsye kryesore se është vendimtare për pothuajse të gjithë jetën.
Zbulimi i karbonit është i humbur nga historia. Elementi ishte i njohur për njerëzit parahistorikë në formën e qymyrit. Karboni si qymyr është ende një burim i madh karburanti në mbarë botën, duke siguruar rreth 37% të elektricitetit në botë, sipas Shoqatës Botërore të Qymyrit. Qymyri është gjithashtu një komponent kyç në prodhimin e çelikut, ndërsa grafiti, një formë tjetër e karbonit, është një lubrifikant industrial i zakonshëm.
Karboni-14 është një izotop radioaktiv i karbonit i përdorur nga arkeologët deri më sot objektet dhe mbetjet. Karboni-14 po ndodh natyrshëm në atmosferë. Bimët e marrin atë në frymëmarrje, në të cilën ata konvertojnë sheqernat e bëra gjatë fotosintezës përsëri në energji që përdorin për të rritur dhe mbajtur procese të tjera, sipas Iowa State University Center for Nondestructive Evaluation. Kafshët inkorporojnë karbonin-14 në trupin e tyre duke ngrënë bimë ose kafshë të tjera që hanë bimë. Karboni-14 ka një gjysmë-jetë prej 5.730 vjetësh, që do të thotë se pas kësaj kohe, gjysma e karbonit-14 në një mostër prishet, sipas Universitetit të Arizonës.
Për shkak se organizmat ndalojnë marrjen e karbonit-14 pas vdekjes, shkencëtarët mund të përdorin gjysmë-jetën e karbonit-14 si një lloj ore për të matur se sa kohë ka kaluar që kur organizmi vdiq. Kjo metodë punon në organizmat dikur të gjallë, duke përfshirë objekte të bëra nga druri ose materiale të tjera bimore.
Karboni: Kush e dinte?
- Karboni e merr emrin nga fjala latine karbo, që do të thotë «qymyr».
- Diamantet dhe grafiti janë ndër materialet natyrore më të vështira dhe më të buta të njohura, respektivisht. I vetmi ndryshim midis të dyve është struktura e tyre kristalore.
- Karboni përbën 0.032% të litosferës së Tokës (kore dhe mantel i jashtëm) sipas peshës, sipas Encyclopedia of Earth. Një vlerësim i përafërt i peshës së litosferës nga gjeologu David Smith i Universitetit La Salle është 300.000.000.000.000.000.000.000 (ose 3*10^23) paund, duke e bërë peshën e përafërt të karbonit në lithosferë 10.560.000.000.000.000.000.000.000 (10.000.000.000).000
- Dioksidi i karbonit (një atom karboni plus dy atome oksigjeni) përbën rreth 0,04% të atmosferës së Tokës, sipas Administratës Kombëtare Oqeanike dhe Atmosferike (NOAA) — një rritje mbi kohët paraindustriale, për shkak të djegies së lëndëve djegëse fosile.
- Monoksidi i karbonit (një atom karboni plus një atom oksigjeni) është një gaz pa erë i prodhuar nga djegia e lëndëve djegëse fosile. Monoksidi i karbonit vret duke u lidhur me hemoglobinën, përbërjen që mbart oksigjenin në gjak. Monoksidi i karbonit lidhet me hemoglobinën 210 herë më fort se oksigjeni lidhet me hemoglobinën, duke shpërndarë efektivisht oksigjenin dhe duke mbytur indet, sipas një shkrimi të vitit 2001 në Journal of the Royal Society of Medicine.
- Diamanti, versioni më flashiest i karbonit, formohet nën presion të madh thellë në koren e Tokës. Diamanti më i madh i cilësisë së çmuar që është gjetur ndonjëherë ishte diamanti Cullinan, i cili u zbulua në vitin 1905, sipas Royal Collection Trust. Diamanti i paprerë ishte 3.106.75 carat. Xhevahiri më i madh i prerë nga guri, me 530.2 carat, është një nga Xhevahirët e Kurorës së Mbretërisë së Bashkuar dhe njihet si Ylli i Madh i Afrikës.
- Tatuazhet e Ötzi the Iceman, një kufomë 5.300-vjeçare e gjetur e ngrirë në Alpe, u shkruan nga karboni, sipas një studimi të vitit 2009 në Journal of Archaeological Science. U bënë prerje të vogla në lëkurë dhe qymyr druri u fërkua, ndoshta si pjesë e një trajtimi akupunkturor.
Kërkime të vazhdueshme
Karboni është një element i studiuar prej kohësh, por kjo nuk do të thotë se nuk ka më shumë për të zbuluar. Në fakt, i njëjti element që paraardhësit tanë parahistorikë dogjën si qymyr druri mund të jetë çelësi i materialeve teknologjike të gjeneratës së ardhshme.
Në vitin 1985, Rick Smalley dhe Robert Curl nga Universiteti Rice në Teksas dhe kolegët e tyre zbuluan një formë të re të karbonit. Duke avulluar grafitin me lazer, shkencëtarët krijuan një molekulë të re misterioze të bërë me karbon të pastër, sipas Shoqatës Amerikane të Kimikateve. Kjo molekulë doli të jetë një sferë në formë topi futbolli e bërë nga 60 atome karboni. Ekipi kërkimor e quajti zbulimin e tyre buckminsterfullerene sipas një arkitekti që projektoi kupola gjeodezike. Molekula tani njihet më shpesh si “buckyball”. Studiuesit që e zbuluan atë fituan një çmim Nobel në kimi në vitin 1996. Buckyballs janë gjetur për të penguar përhapjen e HIV, sipas një studimi të botuar në vitin 2009 në Journal of Chemical Information and Modeling; Hulumtuesit mjekësorë po punojnë për të lidhur ilaçe, molekulë-nga-molekula, në Buckyballs në mënyrë që të dorëzojnë ilaçe direkt në vendet e infeksionit ose tumoreve në trup; Kjo përfshin kërkime nga Columbia University, Rice University dhe të tjerë. Në vitin 2021, studiuesit e udhëhequr nga Yongjun Tian i Universitetit Yanshan në Kinë zbuluan se duke kompresuar buckyballs, ata mund të bënin materialin më të vështirë jo kristalor që është parë ndonjëherë, pothuajse po aq i fortë sa diamanti.

Janë zbuluar molekula të tjera të reja dhe të pastra të karbonit, të quajtura fullerenes, duke përfshirë “buckyeggs” në formë eliptike dhe nanotube karboni me veti përçuese mahnitëse. Kimia e karbonit është ende mjaft e nxehtë për të kapur çmimet Nobel: Në vitin 2010, studiuesit nga Japonia dhe Shtetet e Bashkuara fituan një për të kuptuar se si të lidhin atomet e karbonit së bashku duke përdorur atome palladium, një metodë që mundëson prodhimin e molekulave të mëdha dhe komplekse të karbonit, sipas Fondacionit Nobel.
Shkencëtarët dhe inxhinierët po punojnë me këto nanomateriale karboni për të ndërtuar materiale menjëherë jashtë shkencës-fiction. Një gazetë e vitit 2010 në revistën Nano Letters raportoi shpikjen e tekstileve fleksibël dhe përçues të zhytur në një “bojë” nanotube karboni që mund të përdorej për të ruajtur energjinë, ndoshta duke hapur rrugën për bateritë e veshura, qelizat diellore dhe elektronikë të tjera. Boja tani është në dispozicion komercialisht nga kompanitë e furnizimit kimik.
Megjithatë, ndoshta një nga zonat më të nxehta në kërkimet për karbonin sot përfshin grafenin «material mrekullibërës». Grafeni është një fletë karboni vetëm një atom i trashë. Është materiali më i fortë i njohur ndërsa është ende ultra i lehtë dhe fleksibël. Dhe e kryen elektricitetin më mirë se bakri. Shkencëtarët ende po zbulojnë veti të reja të grafenit. Në vitin 2020, për shembull, studiuesit raportuan në revistën Nature Physics se duke e grumbulluar grafenin në mënyrën e duhur, mund ta bënin atë magnetik.
Grafeni që prodhon në masë është një sfidë, megjithëse studiuesit në prill të vitit 2014 raportuan se mund të bënin sasi të mëdha duke mos përdorur gjë tjetër veçse një blender kuzhine. Në vitin 2020, shkencëtarët në TU Delft në Holandë zhvilluan një model matematikor për të udhëhequr prodhimin në shkallë të gjerë. Nëse shkencëtarët arrijnë të kuptojnë se si të bëjnë shumë grafenë lehtësisht, materiali mund të bëhet i madh në teknologji. Përfytyroni pajisje elastike dhe të pathyeshme që ndodhin edhe të holla në letër. Karboni ka ardhur shumë larg qymyrit dhe diamanteve, në të vërtetë.
Nanotubat e karbonit
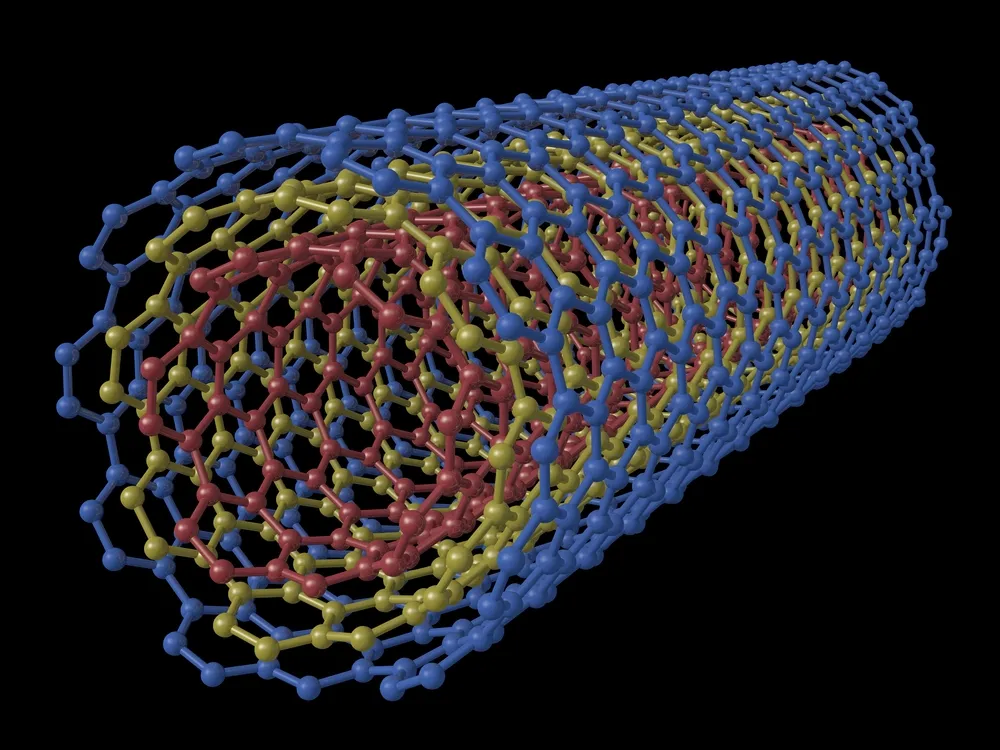
Një nanotube karboni (CNT) është një strukturë minuscule, si kashtë, e bërë nga atomet e karbonit. Këto tuba janë jashtëzakonisht të dobishme në një shumëllojshmëri të gjerë të teknologjive elektronike, magnetike dhe mekanike. Diametri i këtyre tubave është kaq i vogël, saqë matet në nanometër. Një nanometër është një e miliardta e një metri — rreth 10.000 herë më e vogël se flokët e njeriut.
Nanotubat e karbonit janë të paktën 100 herë më të fortë se çeliku, por vetëm një e gjashta si e rëndë, kështu që ato mund të shtojnë forcë në pothuajse çdo material, sipas UnderstandingNano.com Ato janë gjithashtu më të mira se bakri në kryerjen e elektricitetit dhe ngrohjes.
Nanoteknologjia po aplikohet në kërkimin për ta kthyer ujin e detit në ujë të pijshëm. Në një studim të ri, shkencëtarët e Laboratorit Kombëtar Lawrence Livermore (LLNL) kanë zhvilluar një proces nanotube karboni që mund ta nxjerrë kripën nga uji i detit shumë më me efektshmëri se teknologjitë tradicionale.
Për shembull, proceset tradicionale të desalinimit pompojnë në ujin e detit nën presion të lartë, duke e dërguar atë nëpërmjet membranave të osmozës së kundërt. Këto membrana pastaj hedhin poshtë të gjitha grimcat e mëdha, duke përfshirë kripërat, duke lejuar vetëm ujë të pastër të kalojë nëpër. Megjithatë, këto impiante desalinimi janë shumë të shtrenjta dhe mund të përpunojnë vetëm rreth 10 për qind të nevojave ujore të një qarku, sipas LLNL.
Në studimin e nanotubes, shkencëtarët imituan mënyrën e strukturimit të membranave biologjike: në thelb një matricë me pore brenda membranës. Ata përdorën nanotube që ishin veçanërisht të vogla — më shumë se 50.000 herë më të holla se flokët e njeriut. Këto nanotube të vockla lejojnë një fluks shumë të lartë uji, por janë kaq të ngushta, saqë vetëm një molekulë uji mund të kalojë përmes tubit në një kohë. Dhe më e rëndësishmja, jonet e kripës janë shumë të mëdha për t’u përshtatur përmes tubit.
Studiuesit mendojnë se zbulimi i ri ka pasoja të rëndësishme për gjeneratën e ardhshme si të proceseve të pastrimit të ujit, ashtu edhe të teknologjive membranë me fluks të lartë.
Njoftime shtesë nga Traci Pedersen, kontribues i Live Science.
Burime shtesë
- Mësoni më shumë rreth elementit karbon në faqen e internetit të Jefferson Lab National Accelerator Facility.
- Observatori i Tokës i NASA-s ka një përshkrim të plotë të ciklit të karbonit, nga mënyra se si formohet deri në çiklizmin e tij nëpër ekosistemet e Tokës, me një pjesë të atij karboni që emetohet në atmosferë.
- Mësoni më shumë rreth karbonit dhe diamanteve në Institucionin Smithsonian.
Bibliografia
King, H. “Diamant.” Geology.com. Aksesuar më 10 mars 2022.
Tiwari, S.K., et al. “Graphene research and their outputs: Status and prospect,” Journal of Science: Advanced Materials and Devices, Vol. 5, No. 1, 10-29, March 2020. https://doi.org/10.1016/j.jsamd.2020.01.006.
Rao, R., et al. “Carbon Nanotubes and Related Nanomaterials: Critical Advances and Challenges for Synthesis toward Mainstream Commercial Applications,” ACS Nano 2018, 12, 12, 11756-11784, 5 dhjetor 2018. https://doi.org/10.1021/acsnano.8b06511
Regjistrohu në buletinin e përditshëm Live Science tani
Merrni zbulimet më magjepsëse në botë të dorëzuara direkt në inbox-in tuaj.
Top of Form
Më kontaktoni me lajme dhe oferta nga marka të tjera FutureMerrni email nga ne në emër të partnerëve tanë të besuar ose sponsorëve
Bottom of Form
Duke paraqitur informacionin tuaj, ju pranoni Kushtet dhe Politikën e Privatësisë dhe jeni 16 vjeç ose më shumë.
TEMAT
Stephanie Pappas – Kontribuesi e Live Science.
Stephanie Pappas është një shkrimtare kontribuese për Live Science, duke mbuluar tema që variojnë nga gjeoshkenca deri te arkeologjia e deri te truri dhe sjellja e njeriut. Ajo më parë ishte shkrimtare e lartë për Live Science, por tani është freelancer me seli në Denver, Colorado, dhe kontribuon rregullisht në Scientific American dhe The Monitor, revista mujore e Shoqatës Psikologjike Amerikane. Stephanie mori një diplomë bachelor në psikologji nga Universiteti i Karolinës së Jugut dhe një çertifikatë të diplomuar në komunikimin shkencor nga Universiteti i Kalifornisë, Santa Cruz.
–
Referenca>