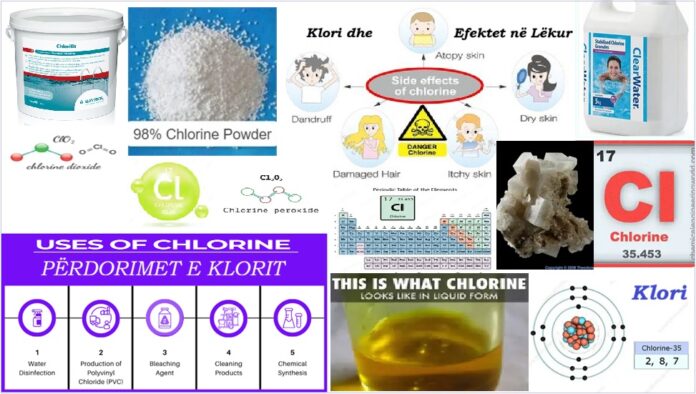
Klori (Cl), është element kimik,me numrin atomik (Z) 17, numri i masës (A) 35.45, i cili është në grupin e 17-të të sistemit periodik. Klori anëtari i dytë më i lehtë i elementeve halogjene, ose Grupi 17 (Grupi VIIa) i tabelës periodike. Klori është një gaz toksik, gërryes, i verdhë jeshile që irriton sytë dhe sistemin e frymëmarrjes.
Pamja
Një gaz i dendur i verdhë-jeshil me një erë mbytëse.

Klori i ruajtur në formën natyrale.
Klori luajti një rol të rëndësishëm në eksperimentet e kryera nga alkimistët mesjetarë, të cilat zakonisht përfshinin ngrohjen e kripërave të klorurit si kloruri i amonit (sal ammoniak) dhe klorur natriumi (kripa e zakonshme), duke prodhuar substanca të ndryshme kimike që përmbajnë klor si klorur hidrogjeni, klorur merkuri (II) (sublimat gërryes) dhe aqua regia. Megjithatë, natyra e gazit të klorit të lirë si një substancë e veçantë u njoh vetëm rreth vitit 1630 nga Jan Baptist van Helmont. Carl Wilhelm Scheele shkroi një përshkrim të gazit të klorit në 1774, duke supozuar se ai ishte një oksid i një elementi të ri. Në 1809, kimistët sugjeruan se gazi mund të ishte një element i pastër, dhe kjo u konfirmua nga Sir Humphry Davy në 1810, i cili e quajti atë sipas greqishtes së lashtë χλωρός (khlōrós, “jeshile e zbehtë”) për shkak të ngjyrës së tij.[1]
Aplikimet
Klori vret bakteret – është një dezinfektues. Përdoret për trajtimin e ujit të pijshëm dhe ujit të pishinës. Përdoret gjithashtu për të bërë qindra produkte të konsumit nga letra te bojërat dhe nga tekstilet te insekticidet.
Rreth 20% e klorit të prodhuar përdoret për prodhimin e PVC. Kjo është një plastikë shumë e gjithanshme që përdoret në kornizat e dritareve, ambientet e brendshme të makinave, izolimin e instalimeve elektrike, tubat e ujit, qeset e gjakut dhe dyshemetë vinili.
Një tjetër përdorim i madh i klorit është në kiminë organike. Përdoret si agjent oksidues dhe në reaksionet zëvendësuese. 85% e farmaceutikëve përdorin klor ose përbërësit e tij në një fazë të prodhimit të tyre.
Në të kaluarën klori përdorej zakonisht për të bërë kloroform (një anestezi) dhe tetrakorur karboni (një tretës për pastrim kimik). Megjithatë, të dyja këto kimikate tani kontrollohen rreptësisht pasi mund të shkaktojnë dëmtim të mëlçisë.
Gazi i klorit është në vetvete shumë helmues dhe u përdor si armë kimike gjatë Luftës së Parë Botërore.
Roli biologjik
Joni i klorurit është thelbësor për jetën. Është kryesisht i pranishëm në lëngun qelizor si një jon negativ për të balancuar jonet pozitive (kryesisht kalium). Është gjithashtu i pranishëm në lëngun jashtëqelizor (p.sh. gjak) për të balancuar jonet pozitive (kryesisht natriumi).
Ne marrim pjesën më të madhe të klorurit që na nevojitet nga kripa. Marrja tipike ditore e kripës është rreth 6 gram, por ne mund t’ia dilnim me gjysmën e kësaj sasie. [2]
Bollëku natyror
Klori nuk gjendet i pakombinuar në natyrë. Haliti (klorur natriumi ose ‘kripa e zakonshme’) është minerali kryesor që nxirret për klorin. Kloruri i natriumit është një kripë shumë e tretshme që është kulluar në oqeane gjatë jetës së Tokës. Disa shtretër kripe, ose ‘liqene’ gjenden aty ku detet e lashta janë avulluar, dhe këto mund të nxirren për klorur.
Klori gjendet gjithashtu në mineralet carnallite (magnez, klorur, kalium) dhe silvit (klorur kaliumi).
40 milionë tonë gaz klori prodhohen çdo vit nga elektroliza e shëllirës (tretësira e klorurit të natriumit). Ky proces prodhon gjithashtu hidroksid të dobishëm natriumi.
[Britannica3: Lidhja jonike: klorur natriumi ose kripë tryezeLidhja jonike në klorur natriumi. Një atom natriumi (Na) i dhuron një nga elektronet e tij një atomi klori (Cl) në një reaksion kimik, dhe joni pozitiv (Na) dhe joni negativ (Cl+−) formojnë një përbërje jonike të qëndrueshme (klorur natriumi; kripë e zakonshme tryeze) bazuar në këtë lidhje jonike.
Kripa e gurit (kripa e zakonshme, ose klorur natriumi) është e njohur për disa mijëra vjet. Është përbërësi kryesor i kripërave të tretura në ujin e detit, nga i cili merrej në Egjiptin e lashtë me avullim. Në kohën romake, ushtarët paguheshin pjesërisht me kripë (salarium, rrënja e fjalës moderne rrogë). Në 1648 kimisti gjerman Johann Rudolf Glauber mori një acid të fortë, të cilin ai e quajti shpirt kripë, duke ngrohur kripën e lagësht në një furrë qymyri dhe duke kondensuar tymrat në një marrës. Më vonë ai mori të njëjtin produkt, tani i njohur si acid klorhidrik, duke ngrohur kripën me acid sulfurik.
Në 1774 kimisti suedez Carl Wilhelm Scheele trajtoi oksidin e zi pluhur të manganit me acid klorhidrik dhe mori një gaz të gjelbër-të verdhë, të cilin ai nuk arriti ta njihte si element. Natyra e vërtetë e gazit si element u njoh në 1810 nga kimisti anglez Humphry Davy, i cili më vonë e quajti klor (nga greqishtja chloros, që do të thotë “jeshile e verdhë”) dhe dha një shpjegim për veprimin e tij zbardhues.
Shfaqja dhe shpërndarja
Përveç sasive shumë të vogla të klorit të lirë (Cl) në gazrat vullkanikë, klori zakonisht gjendet vetëm në formën e komponimeve kimike. Ai përbën 0.017 për qind të kores së Tokës. Klori natyral është një përzierje e dy izotopeve të qëndrueshme: klori-35 (75.53 përqind) dhe klori-37 (24.47 përqind). Përbërësi më i zakonshëm i klorit është kloruri i natriumit, i cili gjendet në natyrë si kripë guri kristalore, shpesh e zbardhur nga papastërtitë. Kloruri i natriumit është gjithashtu i pranishëm në ujin e detit, i cili ka një përqendrim mesatar prej rreth 2 për qind të asaj kripe. Disa dete pa dalje në det, të tilla si Deti Kaspik, Deti i Vdekur dhe Liqeni i Madh i Kripës së Utah, përmbajnë deri në 33 për qind kripë të tretur. Sasi të vogla të klorurit të natriumit janë të pranishme në gjak dhe në qumësht. Minerale të tjera që përmbajnë klor janë silviti (kloruri i kaliumit [KCl]), biskofiti (MgCl2 ∙6H2O), karnaliti (KCl∙MgCl2 ∙6H2O) dhe kainitit (KCl∙MgSO4 ∙3H2O). Gjendet në mineralet e evaporitit si klorapatiti dhe sodaliti. Acidi klorhidrik i lirë është i pranishëm në stomak.]
–
Referencat