Kur dy elemente kombinohen, masat e një elementi veproin me një masë fikse në elementit e dytë në një raport të numrave të thjeshtë.
Çifte e njëjta të elementeve të caktuara mund të kombinohen për të formuar më shumë se një përbërje.
Elementet e karbonit dhe oksigjenit të kombinuara në një mënyrë, ato formojnë monoksid karboni dhe dioksidin e karbonit të përbërë familjarisht.
Çdo mostër e monoksidit të karbonit, përmban 16.0 g Oksigjen për çdo 12.0 g Karbon. Ky është një raport masiv i oksigjenit me karbonin prej 1.33 me 1.
Në çdo mostër të dioksidit të karbonit, ka 32.0g Oksigjen, i pranishëm për çdo 12.0g Karbon. Duke u ndarë 32.0 nga 12.0, kjo thjeshton në një raport masiv të oksigjenit me karbonin prej 2,66 me 1.
Në dioksidin e karbonit, ka saktësisht dy herë më shumë oksigjen të pranishëm se sa në monoksidin e karbonit.
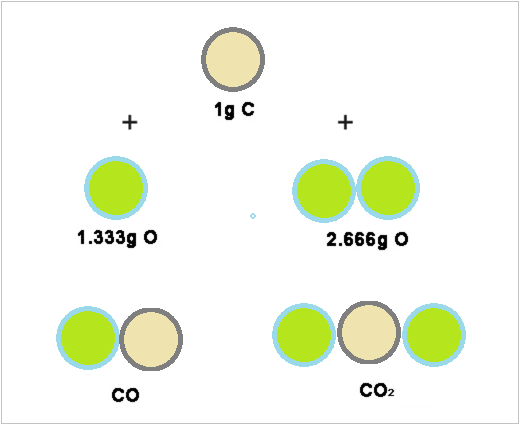
Imazhi tregon: Në monoksidin e karbonit, në të majtë, ka 1.333g Oksigjen për çdo 1g Karbon. Në dioksidin e karbonit, në të djathtë, ka 2.666g Oksigjen për çdo 1gram Karbon. Pra raporti i oksigjenit në dy komponimet është 1:2, një raport i vogël i të gjithë numrit.
Ligji i përmasave të shumëfishta ose Ligji i proporcioneve të shumëfishta thotë se sa herë që të njëjtat dy elemente formojnë më shumë se një përbërje, masat e ndryshme të një elementi që kombinohen me të njëjtën masë të elementit tjetër janë në raportin e numrave të vegjël të tërë. (1)
Për shembull, ka pesë okside të dallueshme të azotit dhe peshat e oksigjenit në kombinim me 14 gramë azot janë, në rend në rritje, 8, 16, 24, 32 dhe 40 gramë, ose në një raport prej 1, 2, 3, 4, 5.
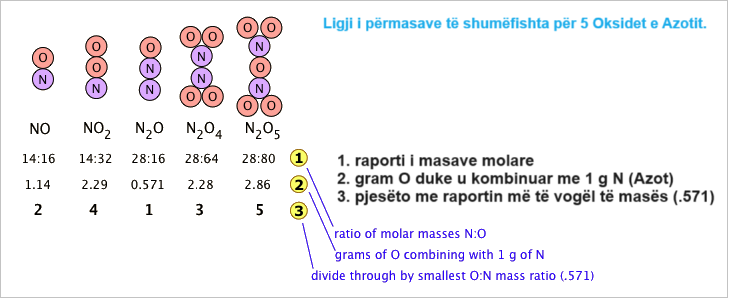
Ligji i proporcioneve të shumëfishta, pohon se kur dy elemente kombinohen me njëri-tjetrin për të formuar më shumë se një përbërje, peshat e një elementi që kombinohen me një peshë fikse të tjetrit janë në një raport të numrave të vegjël të tërë.
Ligji u shpall (1803) nga kimisti anglez John Dalton, dhe konfirmimi i tij për një gamë të gjerë komponimesh shërbeu si argumenti më i fuqishëm në mbështetje të teorisë së Daltonit se lënda përbëhet nga atome të pandashme. (2)
Në kimi, ligji i proporcioneve të shumta thotë se në komponimet që përmbajnë dy elemente kimike të veçanta, sasia e elementit A për masë të elementit B do të ndryshojë në të gjithë këto komponime sipas raporteve të numrave të vegjël të tërë.
Për shembull, ethyleni ka dy herë më shumë karbon për masë hidrogjeni sesa metani. Ky ligj njihet edhe si Ligji i Daltonit, i quajtur sipas John Dalton, kimistit që e shprehu për herë të parë. Zbulimi i këtij modeli bëri që Dalton të zhvillonte teorinë moderne të atomeve, pasi sugjeronte se elementet kombinohen me njëri-tjetrin me sasi minimale diskrete, me pesha të qëndrueshme për çdo element. Ligji i proporcioneve të shumta shpesh nuk zbatohet kur krahasohen molekulat shumë të mëdha. Për shembull, nëse dikush do të përpiqej ta demonstronte atë duke përdorur hidrokarburet decane (formula kimike C10H22) dhe undecane (C11H24), do të gjenim se 100 gramë karbon mund të reagonte me 18.46 gramë hidrogjen për të prodhuar dekan ose me 18.31 gramë hidrogjen për të prodhuar jodecane, për një raport të masave të hidrogjenit prej 121:12, që vështirë se është një raport i numrave të tërë “të vegjël”. (3).
Reference:



