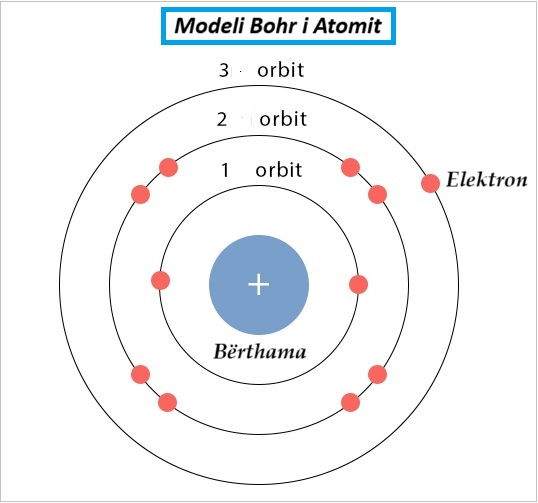
Modeli Bohr është një model planetar i atomiti propozuar nga fizikani danez Niels Bohr në 1913. Ai përbëhet nga një bërthamë e vogël dhe e dendur e rrethuar nga elektrone në orbitë. Modeli Bohr ishte i pari që përfshiu teorinë kuantike dhe ishte paraardhësi i modeleve tërësisht kuantike-mekanike.
Modeli Bohr ka një atom të përbërë nga një bërthamë e vogël, e ngarkuar pozitivisht e orbituar nga elektrone të ngarkuara negativisht. Modeli Bohr është një model planetar në të cilin elektronet e ngarkuara negativisht rrotullohen rreth një bërthame të vogël, të ngarkuar pozitivisht të ngjashme me planetët që rrotullohen rreth diellit (përveç se orbitat nuk janë të rrafshuara).
Pasqyrë e Modelit Bohr
Niels Bohr1 propozoi Modelin Bohr të Atomit në 1915. Për shkak se Modeli Bohr është një modifikim i modelit të mëparshëm Rutherford, disa njerëz e quajnë Modelin Bohr Modeli Rutherford-Bohr. Modeli modern i atomit bazohet në mekanikën kuantike. Modeli Bohr përmban disa gabime, por është i rëndësishëm sepse përshkruan shumicën e veçorive të pranuara të teorisë atomike pa të gjithë matematikën e nivelit të lartë të versionit modern. Ndryshe nga modelet e mëparshme, Modeli Bohr shpjegon formulën Rydberg për linjat e emetimit spektral të hidrogjenit atomik.2
Pikat kryesore
- Modeli Bohr tregon se elektronet rrotullohen rreth një bërthame të vogël, të ngarkuar pozitivisht si planetët rreth diellit.
- Në modelin Bohr, energjia ndryshon kur elektronet kërcejnë midis orbitave të ndryshme rreth bërthamës.
- Megjithëse i dobishëm, Modeli Bohr ka kufizime dhe është zëvendësuar nga modeli modern i mekanikës kuantike.
Çfarë është Modeli Bohr
Modeli Bohr përfaqëson strukturën e një atomi të zhvilluar nga fizikani danez Niels Bohr në 1913. Sipas këtij modeli, struktura atomike është e ngjashme me atë të sistemit diellor. Bërthama përfaqëson diellin dhe elektronet përfaqësojnë planetët që rrotullohen rreth bërthamës. Ndryshe nga forcat gravitacionale që mbajnë planetët në orbitat e tyre, elektronet mbahen në orbitat e tyre nga forcat elektrostatike. Kështu, modeli Bohr shpesh quhet modeli planetar.]3
Karakteristikat kryesore të modelit Bohr
- Elektronet lëvizin rreth bërthamës në orbita me rreze të përcaktuar mirë.
- Elektronet që rrotullohen në orbita nuk ndërveprojnë me njëra-tjetrën.
- Energjia e elektronit varet nga numri kryesor kuantik4 n.
- Sipas marrëdhënies së Planck, kur një elektron lëviz nga një orbitë në tjetrën, ai thith ose lëshon rrezatim.
Zhvillimi i modelit Bohr
Si ndryshon modeli atomik i Bohr nga modeli i Rutherford
Disa eksperimente të bëra nga fizikani i Zelandës së Re Ernest Rutherford vërtetuan se një atom përbëhet nga një bërthamë e ngarkuar pozitivisht e rrethuar nga një re elektronesh të ngarkuara negativisht. Rutherford zhvilloi modelin e tij në 1911, i cili njihet edhe si modeli klasik. Megjithatë, ky model ka disa të meta. Nuk arrin të shpjegojë pse elektronet nuk spiralizohen brenda gjatë lëvizjes së tyre dhe shemben në bërthamë. Me fjalë të tjera, nuk shpjegon pse atomet janë të qëndrueshme. Për më tepër, modeli klasik konsideron se elektronet që rrotullohen rreth orbitave lëshojnë rrezatim të vazhdueshëm, i cili nuk arrin të shpjegojë spektrat e linjës atomike të shumë atomeve.
Bohr aplikoi idetë e tij në modelin Rutherford, dhe për këtë arsye, modeli i tij quhet edhe modeli Bohr-Rutherford. Ai përdori mekanikën kuantike për të shpjeguar linjat spektrale të emetuara nga atomi i hidrogjenit. Sipas Bohr, elektronet rrotullohen rreth bërthamës në orbita rrethore diskrete me rreze të përcaktuara mirë, të cilat varen nga numri kryesor kuantik n. Ndërsa vëzhgonte spektrat e emetimit të atomit të hidrogjenit, Bohr ishte në gjendje të llogariste linjat e imëta spektrale. Ai propozoi që kur një elektron kërcen nga një orbitë më e lartë në një orbitë më të ulët ose më afër bërthamës, ai lëshon rrezatim në formën e dritës.
Modeli Bohr aplikohet në atomin e hidrogjenit
Shembulli më i thjeshtë i modelit Bohr është atomi i ngjashëm me hidrogjenin ose hidrogjenin i përbërë nga një elektron që rrotullohet rreth bërthamës. Në gjendjen e tij bazë, elektroni në orbitën e parë përfaqësohet nga n = 1. Kur rrezatimi hyrës bie mbi atom, elektroni e thith atë dhe kërcen në një gjendje më të lartë (n > 1), e njohur si gjendje e ngacmuar. Megjithatë, kjo gjendje e eksituar është vetëm e përkohshme. Elektroni relaksohet në një gjendje më të ulët, duke lëshuar njëkohësisht rrezatim elektromagnetik në formën e dritës. Është vërejtur eksperimentalisht se lejohen vetëm tranzicione specifike. Për shembull, kalimi nga niveli n ≥ 3 në n = 2 rezulton në një linjë transmetimi të quajtur seria Balmer. Një avantazh i modelit Bohr është se ai mund të shpjegojë spektrat e thithjes dhe emetimit të atomeve të ngjashme me hidrogjenin dhe hidrogjenin.
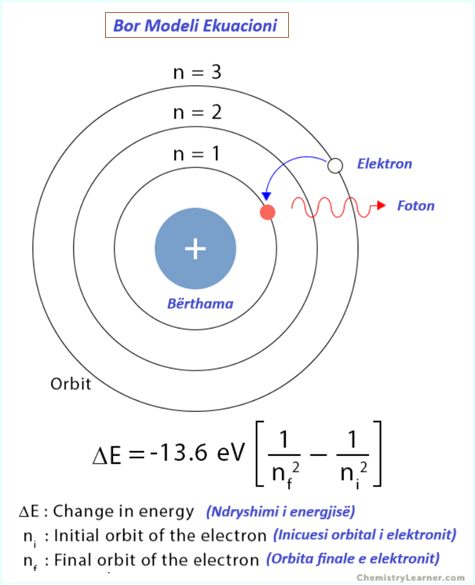
Ekuacioni i modelit Bohr
Bohr zgjidhi gabimin e modelit klasik duke përfshirë teorinë kuantike të Planck-ut dhe efektin fotoelektrik të Ajnshtajnit. Sipas Bohr, orbitat në të cilat banojnë elektronet janë të kuantizuara. Rrezja, momenti këndor dhe energjia marrin vetëm vlera specifike [1,2].
1. Rrezja
Rrezja e orbitës n-të jepet nga,
rn = n2 x rB
Ku,
rn : rrezja e orbitës n-të
rB : rrezja më e vogël e elektroneve të atomit të hidrogjenit, e njohur si rrezja Bohr ( = 0.529 x 10-10 m)
n : numri kryesor kuantik (n = 1,2,3…)
Lejohen vetëm predhat e rrezeve të dhëna nga ekuacioni i mësipërm.
2. Energjia
Në fillim të 20th shekulli, fizikanët Max Planck dhe Albert Einstein zhvilluan teorinë kuantike, e cila thotë se materia thith dhe lëshon rrezatim në paketa diskrete të njohura si kuante. Sipas kësaj teorie, rrezatimi elektromagnetik mund të ekzistojë si valë dhe grimcë. Kur ekziston si grimcë, quhet foton. Energjia e bartur nga një foton jepet nga,
E = hν
Ku,
h : Konstanta e Planck-ut ( = 6.626 x 10-34 J.s)
ν : frekuenca e rrezatimit
Bohr ishte në gjendje ta zbatonte këtë ide kuantizimi në teorinë e tij orbitale atomike dhe zbuloi se energjia orbitale e elektronit në nth orbita e një atomi hidrogjeni jepet nga,
dhen = -13.6/n2 eV
Sipas modelit Bohr, elektronet mund të thithin energji nga një foton dhe të lëvizin në një gjendje të ngacmuar vetëm nëse fotoni ka një energji të barabartë me diferencën e energjisë midis dy niveleve të energjisë. Gjendja e ngacmuar është e paqëndrueshme dhe elektroni kërcen në një nivel më të ulët ndërsa lëshon një foton. Energjia e lëshuar nga një elektron kur kërcen nga një orbitë më e lartë në një orbitë më të ulët është,
ΔE= Ef –dhei
Ku,
dhei : energjia fillestare e elektronit
dhef : energjia përfundimtare e elektronit
ΔE : ndryshimi i energjisë elektronike
Ose, ΔE= -13.6 eV (1/nf2 – 1/ni2)
Aplikoni marrëdhënien e Planck-ut për energjinë e kuantizuar,
ΔE= hν
Kjo energji është negative dhe kështu duke marrë madhësinë,
|ΔE| = hn
Ose, 13.6 eV (1/nf2 – 1/ni2) = hc/λ
Ose, 1/λ = (13.6 eV/hc )(1/nf2 – 1/ni2)
Ose, 1/λ = RH (1/nf2 – 1/ni2)
Ku,
c : shpejtësia e dritës ( = 3 x 108 m/s)
λ : gjatësia vale e rrezatimit ( = c/ν)
RH : Konstanta e Rydberg ( = 13.6 eV/hc = 1.097 x 107 m-1)
Prandaj, gjatësia e valës dhe frekuenca e fotonit të emetuar varen nga numrat kryesorë kuantikë të dy niveleve atomike.
3. Momenti këndor
Bohr postuloi se momenti këndor është gjithashtu i kuantizuar dhe formula e tij jepet nga,
L = nh/2π
Një avantazh i modelit Bohr është se vlerat eksperimentale të rrezeve dhe energjive përputhen me vlerat e llogaritura.
Kufizimet e modelit Bohr
- Ai i konsideron orbitat e elektroneve si rrethore, të ngjashme me modelet e mëparshme klasike
- Ai shkel Parimin e Pasigurisë Heisenberg duke supozuar se rrezja orbitale dhe momenti këndor i elektronit mund të llogariten njëkohësisht
- Nuk vlen për atomet me shumë elektronike dhe nuk mund të shpjegojë spektrat e tyre
- Nuk shpjegon pse disa linja spektrale janë më intensive se të tjerat
- Kjo nuk shpjegon ndarjen e linjave spektrale në prani të një fushe magnetike. Këto linja njihen si dyshe dhe fenomeni quhet efekti Zeeman.
Problemet e praktikës
Problemi 1. Një foton emetohet ndërsa një atom bën një kalim nga n = 5 në n = 2 nivel. Sa është frekuenca, gjatësia e valës dhe energjia e fotonit të emetuar? (Konstanta e Planck, h = 4.135 x 10-15 eV.s) (Shpejtësia e dritës, c = 3 x 108m/s)
Zgjidhja: Dhënë,
nf = 5
ni = 2
Prandaj, energjia është
E = 13.6 eV (1/nf2 – 1/ni2)
Ose, E = 13.6 eV (1/52 – 1/22)
Ose, E = – 2.856 eV
Energjia është negative sepse emetohet fotoni.
Frekuenca mund të llogaritet si më poshtë.
|E| = hν
Ose, n = |E|/h = 2.856 eV/4.135 x 10-15 eV.s
Ose, ν = 7 x 1014 Hz
Dhe, gjatësia e valës është,
λ = c/n = 3 x 108 m / s x 7 x 1014 Hz
Ose, λ = 4.29 x 10-7 m ose 429 nm
Problemi 2. Sa është energjia në elektronvolt të fotonit të prodhuar kur një elektron në një atom hidrogjeni lëviz nga një orbitë me n = 4 në një orbitë tjetër me n = 2?
Zgjidhja: Dhënë,
nf = 4
ni = 2
Prandaj, energjia është
E = 13.6 eV (1/nf2 – 1/ni2)
= 13.6 eV (1/42 – 1/22)
= – 2.25 eV
Shenja negative tregon se elektroni lëshon energji.
References
- Khanacademy.org
- Opentextbc.ca
- Courses.lumenlearning.com
- Chem.libretexts.org
- Thoughtco.com
- Pas.rochester.edu
- Chem.libretexts.org
–
–
Referenca