Numri Atomik (Z) është numri i protoneve që gjendet në bërthamën e një atomi, i cili është karakteristik për një element kimik dhe përcakton vendin e tij në tabelën periodike të elementeve.
Numri atomik identifikohet edhe si numri i ngarkesës së bërthamës. Në një atom me ngarkesë neutrale, numri atomik është i barabartë me numrin e elektroneve.
Renditja e elementeve kimike në tabelën periodik të elementeve bëhet sipas numrit atomik. Tabela periodike klasifikon elementet sipas numrit atomik.
Një atom i një elementi kimik tregohet me anë të një simboli në tabelën periodike të elementeve.
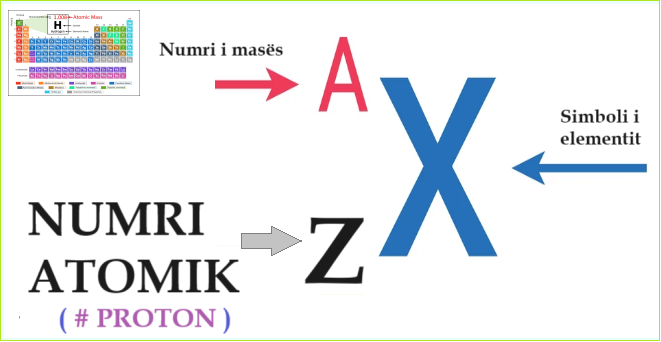
Numri atomik identifikohet me simbolin Z
Numri atomik, numri proton, numri rendor i një elementi (emërtimi Z) është numri i protoneve në bërthamën atomike. Numri atomik është një tipar i një elementi kimik, i cili përcakton vendin e tij në tabelën periodike të elementeve, dhe është i barabartë me numrin e elektroneve në renë elektronike të një atomi neutral. Ajo cilësohet si një nënshkrim i majtë (shembull: për helium, 2He, bakër 29Cu, Oganeson 118Og).
Numri atomik (Z) i një elementi është numri i protoneve në bërthamën e çdo atomi të atij elementi. Numri i elektroneve është i barabartë me numrin e protoneve në një atom të një elementi. Në një atom neutral Numri atomik Z është i barabartë me numrin e elektroneve në mbështjellsin elektronik të një elementi.
Numri atomik (simboli: Z) i një atomi është numri i protoneve në bërthamën e atomit. Ai identifikon në mënyrë unike elementin. Në një atom neutral, numri atomik është i barabartë me numrin e elektroneve që rrotullohen rreth bërthamës. Në thelb, është si një “ID elementar” që na tregon se me cilin element kemi të bëjmë!
Simboli konvencional Z vjen nga fjala gjermane Zahl ‘numër’, e cila, para sintezës moderne të ideve nga kimia dhe fizika, thjesht tregonte vendin numerik të një elementi në tabelën periodike, rendi i të cilit atëherë ishte afërsisht, por jo plotësisht, në përputhje me rendin e elementeve nga peshat atomike. Vetëm pas vitit 1915, me sugjerimin dhe dëshminë se ky numër Z ishte edhe ngarkesa bërthamore dhe një karakteristikë fizike e atomeve, fjala Atomzahl (dhe numri i saj atomik ekuivalent anglez) hyri në përdorim të përbashkët në këtë kontekst. (1)
Numri atomik Z (ose Numri protonik) identifikon elementin kimik X që paraqitet me shkronja në tabelën periodike të elementeve.
Përcaktimi (Definimi) i numrit atomik:
Numri atomik i një elementi kimik është numri i protoneve në bërthamën e një atomi të elementit. Është numri i ngarkesës së bërthamës pasi neutronet nuk mbajnë asnjë ngarkesë elektrike neto. Numri atomik përcakton identitetin e një elementi dhe shumë nga vetitë e tij kimike. Tabela periodike moderne urdhërohet nga rritja e numrit atomik.
Numri atomik: Z
Karakteristika e vetme më e rëndësishme e një atomi është numri atomik i tij (zakonisht i përmendur nga shkronja Z), i cili përkufizohet si numri i njësive të ngarkesës pozitive (protonet) në bërthamë. Për shembull, nëse një atom ka një Z prej 6, ai është karboni, ndërsa një Z prej 92 korrespondon me uraniumin. Një atom neutral ka një numër të barabartë protonesh dhe elektronesh në mënyrë që ngarkesat pozitive dhe negative të balancohen saktësisht. Meqë janë elektronet që përcaktojnë se si një atom ndërvepron me një tjetër, në fund të fundit është numri i protoneve në bërthamë që përcakton vetitë kimike të një atomi. (2)
Numri atomik –
Numri i Protoneve në një atom të një elementi është Numri atomik i tij. Kujtoim ose Mos harroni se:
- Të gjitha atomet e një element kanë të njëjtin numër protonesh.
- Atomet e elementeve të ndryshme kanë numra të ndryshëm protonesh.
Një atom përmban numër të barabartë protonesh dhe elektronesh. Meqë protonet dhe elektronet kanë ngarkesa të barabarta dhe të kundërta, kjo do të thotë se atomet nuk kanë ngarkesë të përgjithshme elektrike.
Për shembull, numri atomik i natriumit është 11. Çdo atom natriumi ka 11 protone dhe 11 elektrone. Ajo ka 11 ngarkesa pozitive dhe 11 ngarkesa negative. (3)
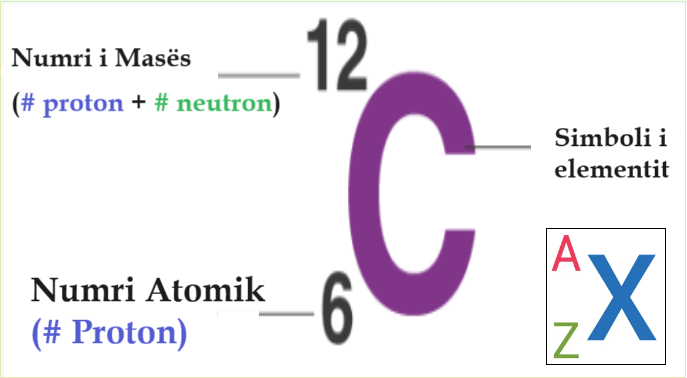
Numrit atomik Z dhe numri i neutronit N jep numrin e masës atomike të atomit A.
Z + N = A
Numri atomik ose numri i ngarkesës bërthamore (simboli Z) i një elementi kimik është numri i ngarkesës së një bërthamë atomike. Për bërthamat e zakonshme të përbëra nga protonet dhe neutronet, kjo është e barabartë me numrin e protonit (np) ose numrin e protoneve që gjenden në bërthamën e çdo atomi të atij elementi. Numri atomik mund të përdoret për të identifikuar në mënyrë unike elementet kimike të zakonshme. Në një atom të zakonshëm të pangarkuar, numri atomik është gjithashtu i barabartë me numrin e elektroneve.
Për një atom të zakonshëm i cili përmban protone, neutrone dhe elektrone, shuma e numrit atomik Z dhe numri i neutronit N jep numrin e masës atomike të atomit A. Meqë protonet dhe neutronet kanë afërsisht të njëjtën masë (dhe masa e elektroneve është e papërfillshme për shumë qëllime) dhe defekti në masë i lidhjes së bërthamës është gjithmonë i vogël në krahasim me masën nukleone, masa atomike e çdo atomi, kur shprehet në daltone (duke bërë një sasi të quajtur “masa izotopike relative”), është brenda 1% të të gjithë numrit A.
Atomet me të njëjtin numër atomik por numra të ndryshëm neutronesh, dhe kështu numra të ndryshëm masash, njihen si izotope. Pak më shumë se tre të katërtat e elementeve që ndodhin natyrshëm ekzistojnë si një përzierje izotopesh (shih elementet monoisotopike), dhe masa izotopike mesatare e një përzierjeje izotopike për një element (të quajtur masa atomike relative) në një mjedis të përcaktuar në Tokë përcakton peshën atomike standarde të elementit. Historikisht, ishin këto pesha atomike të elementeve (në krahasim me hidrogjenin) që ishin sasitë e matshme nga kimistët në shekullin e 19-të.
Rregullat e mësipërme nuk zbatohen gjithmonë për atomet ekzotike të cilat përmbajnë grimca elementare jetëshkurtër përveç protoneve, neutroneve dhe elektroneve. (4)
–
Numri atomik (Z) i një elementi është numri i protoneve në bërthamën e çdo atomi të atij elementi. Kjo do të thotë se numri i protoneve është karakteristikë e cila e bën çdo element unik në krahasim me të gjithë elementët e tjerë. Elementet janë të ndryshme për shkak të numrit të tyre atomik. Tabela periodike shfaq të gjitha elementet e njohura dhe është e rregulluar në mënyrë që të rritet numri atomik. Në këtë tabelë, numri atomik i një elementi tregohet mbi simbolin elementar. Hidrogjeni, në pjesën e sipërme të majtë të tabelës, ka një numër atomik prej 1. Çdo atom hidrogjeni ka një proton në bërthamën e tij. Në vijim në tabelë është helium, atomet e të cilit kanë dy protone në bërthamë. Atomet e litiumit kanë tre protone, e kështu me radhë.
Meqë atomet janë neutrale, numri i elektroneve është i barabartë me numrin e protoneve. Atomet e hidrogjenit kanë të gjithë një elektron që zë hapësirën jashtë bërthamës. Mangani (numri atomik 25) do të kishte njëzet e pesë protone dhe njëzet e pesë elektrone . (5)
Imazh: tabela periodike sipas numrit atomik.

Figura: Tabela periodike klasifikon elementet sipas numrit atomik.
Klasifikimi i elementeve sipas numrit atomik na lejon të kuptojmë shumë veti të atomit dhe bën të mundur parashikimin e sjelljeve në vend që thjesht të duhet të memorizojmë gjithçka.
Çdo element në tabelën periodike ka numrin e vet atomik. Në fakt, ky numër është mënyra se si mund të dalloni një element nga një tjetër. Numri atomik është i thjeshtë.Numri i protoneve në atom. Për këtë arsye, ndonjëherë quhet numër proton. Në llogaritje, ajo shënohet me një kapital Z. Simboli Z vjen nga fjala gjermane Zahl, që do të thotë numër, ose atomzahl , një fjalë më moderne që do të thotë numër atomik.
Teoria atomike aktuale
Në teorinë atomike të materies, një atom përbëhet nga një bërthamë atomike rreth së cilës orbitojnë elektronet. Sot, në përgjithësi është e njohur se bërthama atomike e të gjithë elementeve kimike përbëhet nga protone me ngarkes pozitive dhe neutrone që nuk kanë një ngarkesë elektrike. Grimcat që gjenden në bërthamën atomike, pra protonet dhe neutronet, quhen me emrin e përbashkët bërthama (lat. Nucleus: bërthama). Një neutron ka një masë pothuajse të barabartë me atë të një protoni. Një proton është bërthama e një atomi hidrogjeni, kështu që masa e tij është e barabartë me atë të një atomi hidrogjeni. Numri i protoneve në një bërthamë atomike të quajtur numri atomik është i barabartë me ngarkesën e tij elektrike dhe korrespondon gjithmonë me numrin rendor të një elementi kimik në tabelën periodike. Pra numri atomik përcakton llojin e elementit kimik.
Në një atom neutral, numri i elektroneve që rrotullohen rreth bërthamës është i barabartë me numrin e protoneve në bërthamë. Ngarkesa pozitive e një protoni të vetëm është po aq e madhe sa ngarkesa negative e një elektroni. Në vitin 1869, kimisti rus D. I. Mendeleev zbuloi ligjshmërinë e përsëritjes së vetive kimike të elementeve kur rriti masën atomike të tyre. Më pas ai organizoi të gjitha elementet e njohura duke rritur masat atomike njëra mbi tjetrën dhe përpiloi një tabelë periodike. Mendeleev vërtetoi se çdo element kimik ka një përbërje të caktuar të atomeve që tregon masën atomike dhe vendin në tabelën periodike të elementeve.
Pyetje të shpeshta
A ka elemente tjera të pazbuluara
Meqë protonet janë njësi të materies, numrat atomikë janë gjithmonë numra të plotë. Aktualisht, ato variojnë nga 1 (numri atomik i hidrogjenit) deri në 118 (numri i elementit më të rëndë të njohur). Ndërsa zbulohen më shumë elemente, numri maksimal do të jetë më i lartë. Teorikisht, nuk ka numër maksimal, por elementet bëhen të paqëndrueshme me gjithnjë e më shumë protone dhe neutrone, duke i bërë ato të ndjeshme ndaj prishjes radioaktive. Prishja mund të rezultojë në produkte me një numër atomik më të ulët, ndërsa procesi i fuzionit bërthamor mund të prodhojë atome me një numër më të lartë.
Pse numri atomik është i rëndësishëm
Arsyeja kryesore pse numri atomik është i rëndësishëm është se kështu identifikohet elementi i një atomi. Një arsye tjetër e madhe pse kjo është e rëndësishme është se tabela periodike moderne është organizuar sipas rritjes së numrit atomik. Së fundi, numri atomik është një faktor kyç në përcaktimin e vetive të një elementi. Vini re, megjithatë, se numri i elektroneve të valencës përcakton sjelljen e lidhjes kimike.
Shembuj të numrave atomikë
Pavarësisht se sa neutrone apo elektrone ka, një atom me një proton është gjithmonë numri atomik 1 dhe gjithmonë hidrogjeni. Një atom që përmban gjashtë protone është me përkufizim një atom karboni. Një atom me 55 protone është gjithmonë cesium.
Si të gjeni numrin atomik
Mënyra se si e gjeni numrin tuaj atomik varet nga informacioni që merrni.
Nëse keni një emër ose simbol elementi , përdorni tabelën periodike për të gjetur numrin atomik. Mund të ketë shumë numra në një tabelë periodike, kështu që si e dini se cilin duhet të zgjidhni? Numrat atomikë shkojnë në rregull në tryezë. Ndërsa numrat e tjerë mund të jenë vlera decimale, një numër atomik është gjithmonë një integer i thjeshtë pozitiv. Për shembull, nëse ju thuhet se emri i elementit është alumini, mund të gjeni emrin ose simbolin Al për të përcaktuar numrin atomik 13.
Ju mund të gjeni numrin atomik nga simboli izotop. Ka më shumë se një mënyrë për të shkruar simbole izotopike, por simboli i elementit do të përfshihet gjithmonë. Ju mund të përdorni simbolin për të kërkuar një numër. Për shembull, nëse simboli 14 C, ju e dini se simboli është elementi C ose se elementi është karboni. Numri atomik i karbonit është 6.
Më shpesh, simboli i izotopit tashmë ju tregon për numrin atomik. Për shembull, nëse simboli është shkruar si 14 6 C, numri “6” është specifikuar. Numri atomik është më pak se dy numra në simbol. Zakonisht ndodhet si një indeks në të majtë të simbolit të elementit.
Kushtet që lidhen me numrin atomik
Nëse numri i elektroneve në një atom ndryshon, elementi mbetet i njëjtë, por jonet e reja formohen . Nëse numri i neutroneve ndryshon, ato formohen Izotopet e reja.
Protonet gjenden së bashku me neutronet në bërthamën atomike. Numri i përgjithshëm i protoneve dhe neutroneve në një atom është i tij Numri i masës atomike (i përmendur nga shkronja A). Shuma mesatare e numrit të protoneve dhe neutroneve në mostrën e një elementi është e saj Masa atomike ose pesha atomike.
Kërkimet e elementeve të reja Kur shkencëtarët flasin për sintetizimin ose zbulimin e elementeve të reja, ato nënkuptojnë elemente me një numër atomik më të lartë se 118. Si do të formohen këto elemente? Elementet me numra të rinj atomikë formohen duke bombarduar atomet e synuara me jone. Bërthama e objektivit dhe jonxhës bashkohen për të formuar një element më të rëndë. Është e vështirë t’i karakterizosh këto elemente të reja sepse bërthamat super të rënda janë të paqëndrueshme dhe dekompozohen lehtësisht në elemente më të lehta. Ndonjëherë elementi i ri në vetvete nuk vërehet, por skema e dekompozimit tregon se duhet të jetë formuar një numër atomik më i madh.
Shembuj të numrave atomikë
Përcaktimi i numrit atomik: shih tabelën e elementeve kimike. Numri atomik i hidrogjenit është 1; Numri atomik i karbonit është 6, dhe numri atomik i argjendit është 47: çdo atom me 47 protone është një atom argjendi. Ndryshimi i numrit të neutroneve në një element ndryshon izotopet e tij ndërsa ndryshimi i numrit të elektroneve e bën atë një jon.
I njohur edhe si: Numri atomik është i njohur edhe si numri proton. Ajo mund të përfaqësohet nga shkronja kapitale Z. Përdorimi i shkronjës kapitale Z vjen nga fjala gjermane Atomzahl, që do të thotë “numër atomik”. Para vitit 1915, fjala Zahl (numër) përdorej për të përshkruar pozicionin e një elementi në tabelën periodike.
Marrëdhënia midis numrit atomik dhe vetive kimike
Arsyeja pse numri atomik përcakton vetitë kimike të një elementi është se numri i protoneve përcakton gjithashtu numrin e elektroneve në një atom elektrikisht neutral. Kjo, nga ana e saj, përcakton konfigurimin elektron të atomit dhe natyrën e guaskës së tij më të jashtme ose valence. Sjellja e guaskës së valencës përcakton se sa lehtë një atom do të formojë lidhje kimike dhe do të marrë pjesë në reaksionet kimike.
Elemente të reja dhe numra atomikë
Në kohën e këtij shkrimi, janë identifikuar elementë me numër atomik 1 deri në 118. Shkencëtarët zakonisht flasin për zbulimin e elementeve të reja me numra atomikë më të lartë. Disa studiues besojnë se mund të ketë një “ishull stabiliteti”, ku konfigurimi i protoneve dhe neutroneve të atomeve të mbingarkuara do të jetë më pak i ndjeshëm ndaj prishjes së shpejtë radioaktive që shihet në elementet e rënda të njohura. (6)
-etj.
– Reference:
- Atomic number – Wikipedia –https://en.wikipedia.org/wiki/Atomic_number ↩︎
- Atom | Definition, Structure, History, Examples, Diagram, & Facts | Britannica ↩︎
- Atomic number and mass number – Atomic structure – AQA – GCSE Chemistry (Single Science) Revision – AQA – BBC Bitesize ↩︎
- Atomic number – Wikipedia ↩︎
- 4.16: Atomic Number – Chemistry LibreTexts ↩︎
- Atomic Number Definition – Chemistry Glossary (thoughtco.com) ↩︎