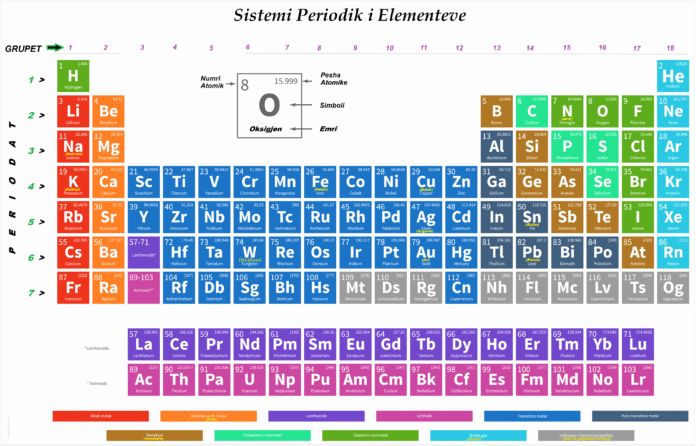
Sistemi periodik i elementeve është tabela me informata të thjeshtuara që përmbajnë elementet kimike si: numrin atomik, simbolin, emrin dhe masën atomike të secilit element.
Sistemi periodik i elementeve është renditja e elementeve kimike në një tabel, duke u bazuar në vetitë kimike dhe vetitë fizike të elementeve. Tabela periodike është një mënyrë për të organizuar elementet kimike në një sistem të përbashkët. Elementet sipas një vetie të caktuar apo shumë vetive, mund të klasifikohen në një e quajtur Lista e Elementeve Kimike, si tabel e përbashkët.
Tabela periodike e elementeve, është skema sipas të cilës renditen elementet kimike bazuar te numri atomik “Z” të tyre. Numri i masës “A” është pjesë që tregon afërsishtë peshën relative të elementeve kimike.
[ I ideuar nga kimisti rus Dmitri Mendeleev (1834-1907), në vitin 1869, dhe në të njëjetën kohë por në mënyre të pavarur nga kimisti gjerman Julius Lothar Meyer (1830 – 1895), fillimisht kishte shumë hapësira boshe të parashikuara për elementet që do të zbuloheshin në të ardhmen, disa prej të cilëve në gjysmën e dytë të viteve 90′. Në nder të kimistit rus sistemi periodik quhet ndryshe dhe tabela e Mendelejevit.]1
Sistemi periodik ndahet në grupe dhe perioda. Ky sistem periodik ka 18 grupe dhe 7 perioda. Periodat janë rende horizontale, ndërsa grupet në rende vertikale. Në këtë tabelë, secili element është i shënuar me simbolin perkatës. Periodat 1,2 dhe 3 janë perioda te shkurtra. Periodat 4 dhe 5 janë perioda te gjata . Periodat 6 e 7 quhet perioda shumë të gjata. Elektronet e shtresës së fundit quhen elektrone valentore.
- Çdo grup (shtylle e sistemit) përmban elementet të cilët kanë të njëjtin konfigurim elektronik të jashtëm (mënyrën sesi elektronet shpërndahen rreth bërthamës). Brenda çdo grupi gjenden atome me veti të ngjashme.
- –
- Çdo periodë (rresht i tabelës) fillon me një element atomi i të cilit ka një konfigurim të jashtëm të tipit “s” ose “ns”, ku “n” është numri kuantik parësor, dhe duke vazhduar në atomet e tjera të periodës, numri atomik “Z” rritet me nga një njësi në çdo kalim.
[
Ashtu si shumë shkencëtarë që punonin në fund të shekullit të 19-të, kimisti rus Dmitri Mendeleev (1834-1907) po kërkonte mënyra për të organizuar Elementet e njohura deri në atë kohë. Mendeleev botoi tabelën e tij të parë periodike të elementeve në 1869.]2
Tabela periodike e elementeve është mjeti më i rëndësishëm i përdorur në kimi. Për të përfituar sa më shumë nga tabela, ju ndihmon të njihni pjesët e tabelës periodike dhe si të përdorni grafikun për të parashikuar vetitë e elementit.
Çështjet kryesore
- Tabela periodike rendit elementet duke rritur numrin atomik, që është numri i protoneve në atomin e një elementi.
- Rreshtat e tabelës periodike quhen perioda. Të gjithë elementët brenda një periudhe ndajnë të njëjtin nivel më të lartë të energjisë elektronike.
- Kolonat e tabelës periodike quhen grupe. Të gjithë elementët në një grup ndajnë të njëjtin numër elektronesh valente.
- Tre kategoritë e gjera të elementeve janë metalet, jometalet dhe metaloidet. Shumica e elementeve janë metale. Jometalet ndodhen në anën e djathtë të tabelës periodike. Metaloidet kanë veti si të metaleve ashtu edhe të jometaleve.
Pjesët kryesore të tabelës periodike
Pjesët kryesore të tabelës periodike janë organizuar në bazë të vetive të elementeve dhe përfshijnë:
1. Rreshtat dhe Kolonat Kryesore
- Periodat (Rreshtat Horizontale): Janë 7 perioda gjithsej. Elementet në të njëjtën periodë kanë të njëjtin nivel më të lartë të energjisë elektronike (ose të njëjtin numër shtresash elektronike).
- Grupet (Kolonat Vertikale): Janë 18 grupe gjithsej. Elementet në të njëjtin grup kanë të njëjtin numër elektronesh valente (elektronet në shtresën e fundit) dhe për këtë arsye shfaqin veti kimike të ngjashme.
2. Kategoritë e Gjëra të Elementeve
Elementet ndahen në tre kategori të gjëra:
- Metalet: Përbëjnë pjesën më të madhe të tabelës, gjenden në të majtë dhe në qendër. Karakterizohen nga përçueshmëri e lartë, shkëlqim dhe lakueshmëri.
- Jometalet (Ose Jo-metale): Gjenden në anën e djathtë të tabelës (përveç Hidrogjenit). Zakonisht janë përçues të dobët dhe nuk kanë shkëlqim metalik.
- Metaloidet (Ose Gjysmë-metale): Gjenden në një vijë diagonale midis metaleve dhe jometaleve. Shfaqin veti si të metaleve ashtu edhe të jometaleve (p.sh. përçueshmëri gjysmëpërçuese).
3. Grupet (Familjet) e Rëndësishme
Disa grupe kanë emra të veçantë për shkak të vetive të tyre të dallueshme:
- Grupi 1: Metalet Alkaline (përveç Hidrogjenit).
- Grupi 2: Metalet Alkalino-Tokësore.
- Grupet 3-12: Metalet Kalimtare.
- Grupi 17: Halogjenet.
- Grupi 18: Gazet e Dobëta (Gazet Fisnike).
- Rreshtat në Fund: Elementet Kalimtare të Brendshme, të ndara në:
- Lantanoidet (seria e Lantanideve, Perioda 6).
- Aktinoidet (seria e Aktinideve, Perioda 7).
A dëshironi të dini më shumë rreth vetive specifike të një grupi apo periudhe të caktuar?
–
Emërtimet e elementeve kimike
Nomenklatura IUPAC3 është një sërë rekomandimesh për emërtimin e përbërjeve kimike dhe për përshkrimin e kimisë dhe biokimisë në përgjithësi. Unioni Ndërkombëtar i Kimisë së Pastër dhe të Aplikuar (IUPAC) është autoriteti ndërkombëtar për nomenklaturën dhe terminologjinë kimike.
Nomenklatura IUPAC është një metodë sistematike për emërtimin e përbërjeve kimike, e zhvilluar nga Unioni Ndërkombëtar i Kimisë së Pastër dhe të Aplikuar (IUPAC), e cila ofron një emër unik dhe të qartë për çdo substancë kimike të dallueshme. Për përbërjet organike, kjo përfshin identifikimin e zinxhirit më të gjatë të karbonit (zinxhiri mëmë), përcaktimin e grupeve funksionale dhe zëvendësuesve, dhe më pas kombinimin e tyre në një emër duke përdorur një emër bazë, një prapashtesë për grupin funksional dhe parashtesa për zëvendësuesit.
Referenca
- Sistemi periodik i elementeve – Wikipedia ↩︎
- Mendeleev’s periodic table – The periodic table – Edexcel – GCSE Chemistry (Single Science) Revision – Edexcel – BBC Bitesize ↩︎
- https://en.wikipedia.org/wiki/IUPAC_nomenclature_of_chemistry
↩︎